651
Чому ми Вік: головний диригент ендокринного оркестру
З ранку до ночі, весь день
Переглядають палички як тіні.
Але якщо сонце спить вночі,
Чи варто час?
Вся історія ідей і концептів в геронології можна коротко описати як історія пошуку «розблокування» старіння. У різні часи, як були присутні такі «години». ендокрин- боги, надниркові залози, щитовидна залоза, гіпофіз.
Відомий вітчизняний геронтолог В.М. Дільман вважає, що час життя нараховує головний «провідник» ендокринного оркестру, розташований на базі мозку. Гіпоталамусй
У той же час в природі є природний механізм, який визначає всі ритми живих організмів - це зміна дня і ночі, світла і темряви. Поворот нашої планети навколо його осі і одночасно навколо Сонця вимірює календарний день, сезони і роки, з якими його мешканці порівнювати тривалість життя.
Природа забезпечила живі організми з пристроєм, здатним процвітати інформацію світла і перетворювати її в сигнали, які контролюють ритми тіла. Центральна частина даного пристрою – верхня придатка мозку, епіфізіс.
Стародавні анатомісти назвали його сосновою залозою для її розкладання до соснового конуса. Субстантивна функція епіфізисТрансмісія інформації про світлий режим навколишнього середовища в внутрішньому середовищі тіла.
Таким чином, організм зберігає фізіологічні ритми, які забезпечують адаптацію до умов навколишнього середовища. У рибі, амфібії, рептилій і птахів, світло проходить через тонкий череп, а епіфізі має можливість безпосередньо сприймати світлові сигнали (запобігає тому, що це називається «третя око».
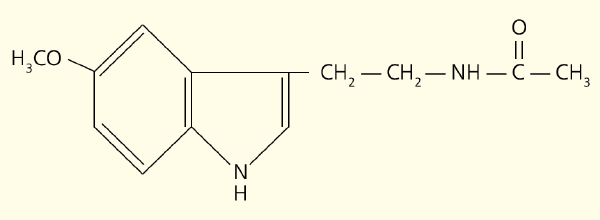
Рис. 1. Структурна формула мелатоніна
У ссавців світло інформації, що сприймається спеціальними клітинами сітківки головиh передається до епіфізісу за допомогою нейронів сапрахімічної нуклеї (SCN) гіпоталамусу через стовбур верхньої грудної частини хребта і симпатических нейронів верхньої шийної ромашки. У темряві сигнали з СНЗ підвищують синтез і випуск норепінафрину з симпатичних закінчень.
У свою чергу, це нейротрансмітент збуджує рецептори, які знаходяться на мембрані клітин епіфізісу (сосновіоцити), стимулюючи синтез мелатонін (рис. 1). Цей головний гормон епіфізісу є похідним біогенного аміну, серотоніну, утвореного з амінокислотного триптофану, що надходить з їжі. Діяльність ферментів, залучених до перетворення серотоніну на мелатонін, пригнічує освітленням. Саме тому цей гормон синтезується вночі, коли його рівень в крові максимальний, а вранці і вдень години мінімальний (рис. 2).
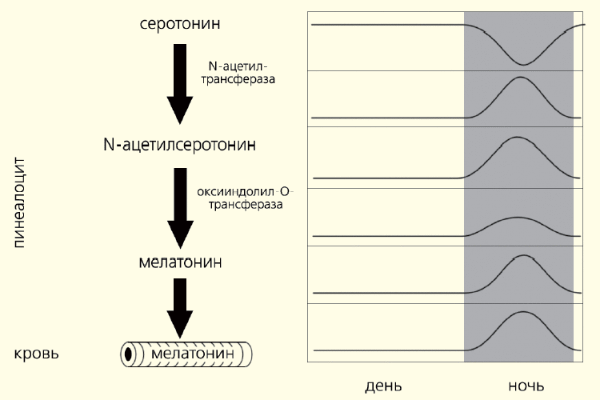
Рис. 2. Біосинтез і щоденний ритм мелатонін
У тілі є також екстрапреналін (формування поза епіфізом) Українськийй Це відкриття належить російським дослідникам Н.Т. Рейхлін і І.М. Квітний: у 1974 році вони виявили, що мелатонін синтезується в клітинах кишкової добавки. Потім вийшов, що цей гормон утворюється в інших частинах шлунково-кишкового тракту, в багатьох інших органах - печінці, нирки, наднирковий жовчний міхур, яєчники, ендометрію, плаценти, тимусу, а також в лейкоцитах, тромбоцитах і ендотелію.
Біологічний ефект екстрапінальної мелатоніну здійснюється безпосередньо там, де він утворюється. Синтез гормонів негормональних клітин підтверджує гіпотезу еволюціональної давнининини гормонів, які, очевидно, з'являються навіть перед ізоляцією ендокриновних залоз. Питання про те, чи є цей шлях синтезу гормонів - фотонезалежний ще не був остаточно вирішений.
Режим світла, мелатонін та регуляція добових біоритмів Якщо епіфізі подобаються біологічним годинником тіла, то мелатонін можна порівняти з педулу, зниженням амплітуди коливань яких призводить до зупинки цих годинників. Ймовірно, це більш точне, щоб подобатися епіфізісу на сонник, в якому мелатонін грає роль тіні від гнома - стрижень, який відливає тінь з сонця. Під час дня сон є високим і тінь коротким (рівень мельатонін мінімальний), в середині ночі - пік синтезу мелатонину епіфізісом і його секреції в кров. Важливо, що мелатонін має циркадний ритм, тобто блок його вимірювання є щоденним обертанням Землі навколо його осі.
Всі біологічні ритми строго обіймають головним водієм, розташованим в супречичному нулі гіпоталаму. Молекулярний механізм формується генами «clock» (Per1, Per2, Per3, Cry-1, Cry-2, Годинники, Bmal1/Mop3, Тим тощо). Показано, що світло безпосередньо впливає на роботу тих з них, які забезпечують циркадський ритм. Ці гени регулюють активність генів ключових клітинних циклів поділу і генів апоптозу. Інфекційний гормон, який передає гідуючі сигнали до органів і тканин, по суті, мелатонін.
Характер відповіді регулюється не тільки своїм рівнем в крові, але і тривалістю відвертого секрету. Крім того, мелатонін надає адаптацію ендогенних біоритмів для постійно мінливих умов навколишнього середовища (рис. 3). Регуляторна роль цього гормону є універсальним для всіх живих організмів, про що свідчить наявність і чіткий ритм синтезу у всіх тварин, починаючи з одноклітинних.
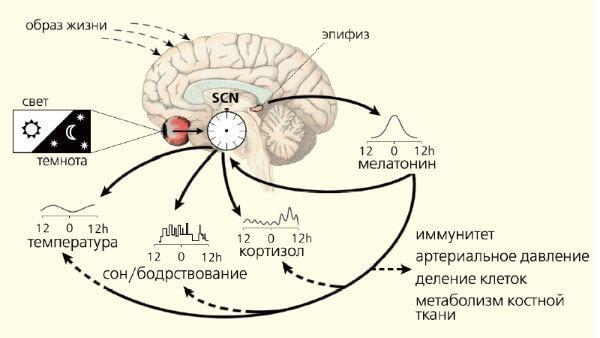
Рис. 3. Синхронізація біоритмів
Завдяки амфіфіфіфільним властивостям (розчинається в воді і жирах), мелатонін долає всі тканинні бар’єри, вільно проходить через клітинні мембрани. Обхід системи рецепторів та сигналізації молекул, взаємодіє з ядерними та мембранними рецепторами, впливає на внутрішньоклітинні процеси. Мелатонін рецептори знаходять в різних ядерах гіпоталаму, сітківці очей та інших тканинах нейрогенної та іншої природи.
У здорових дітей концентрація мелатонину в крові поступово підвищується до року і залишається на досить високому рівні до опуклості. У юних дітей кількість мелатоніна вночі становить близько 40 разів вище, ніж протягом дня. У молодих дітей цей гормон виконує дві функції: продовжує сон і пригнічує секрецію статевих гормонів. Під час статевих губ кількість циркулюючих гормонів в крові знижується, і найбільш чітко під час статевих губ. Відмінність концентрацій нічного та дня скорочена до 10 разів. Визначено, що діти з затримкою статевих губ мають вищі рівні мелатонін. Якщо вміст гормонів продовжує бути високим (five або більше разів вище норми віку), статеві губи затримуються протягом тривалого часу.
Це, ймовірно, через мелатонін, що у дорослих є еротичні мрії. Не без участі, що сон переходить в «рапідний етап» (пардоксичний сон) і яскравий емоційний досвід приходять до життя пам'яті, в тому числі пов'язаних з сексом. У людей віком 60-74 років більшість фізіологічних показників перенесли позитивний фазовий зсув ритму цирккадного ритму близько 1,5-2 годин попереду. У осіб понад 75 років, десинхронізація секрету багатьох гормонів, температури тіла, сну та певних ритмів поведінки часто виникає, що може бути пов'язана з епіфізісом, функція якої пригнічує старінням (рис. 4).
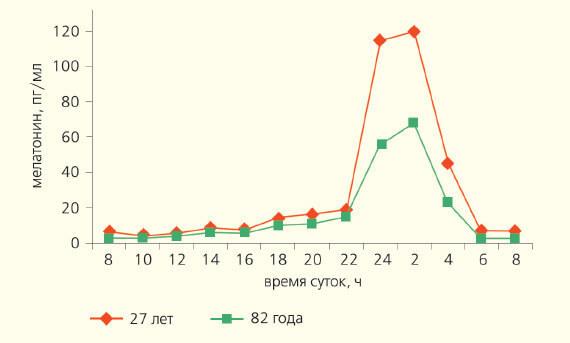
Рис. 4. Щоденний ритм концентрації мелатонін (pg / мл) в крові чоловіків різного віку. На осі координати - мелатонін, рг / мл; на абссисці - час доби, ч.
Якщо епіфізіс є сонцем тіла, то будь-які зміни тривалості денного світла повинні вплинути на його функції і, в кінцевому підсумку, швидкість старіння. У ряді робіт показано, що порушення фотоперіодності може істотно зменшити тривалість життя. Американські дослідники М. Хард і М. Ральф виявили, що золоті хамстери з спеціальною мутацією в гені тау відповідають за вироблення ритмічних сигналів в сапрахімічному ядрі гіпоталамусу жив 20% менше, ніж контрольні. При відновленні головного мозку хамстерів імплантованих клітин гіпоталамусу від здорових тварин, відновлена тривалість життя. У руйнуванні супрахиматичних ядер призводить до зменшення тривалості життя тварин. Порушення функції деяких циркадних генів викликає передчасне старіння і розвиток різних патологічних станів, в тому числі підвищення чутливості мишей до розвитку пухлин (до 1).
 р.
р.
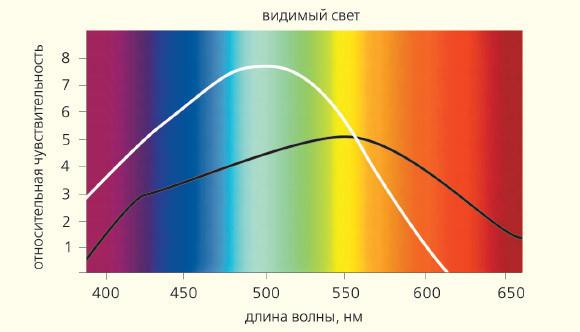
Репродуктивна функція Після винаходу електричного освітлення, нічний світ (попередньо, як легкий забруднення) став важливою частиною сучасного способу життя (рис 5), що веде до серйозних поведінкових та здорових порушень, включаючи серцево-судинні захворювання та рак. Згідно гіпотези «крикадного руйнування», така зміна режиму світла порушує ендогенний добовий ритм, пригнічує пригнічену секрецію мелатоніну і зменшує її концентрацію в крові. Уважно проведені дослідження показали, що освітлення 1.3-4.0 люкс монохромного синього світла або 100 люкс білого світла пригнічує виробництво мелатонину епіфізісом (рис. 6).
Рис. 5. Перегляд Землі з космосу вночі
У лабораторних гризунів штучне збільшення тривалості світлового періоду на 2-4 години продовжує тривалість циклу естра (овуляції) і в деяких випадках порушує його. З постійним (24 годин / день) вплив світла в більшості мишей і щурів дуже швидко настає стан, еквівалентний меніпоузи у жінок. У яєчників таких тварин виявлено кісти і гіперплазія клітин, що виробляють статеві гормони. Замість циклічної секреції гонадотропінів, пролактин, естроген і прогестерон характерний для нормального репродуктивного періоду, ці гормони утворюються ациклічно, що викликає гіперпластичні процеси в молочних залозах і матці. Доведено про те, що вплив світла вночі знижує тривалість менструального циклу у жінок з тривалим (більше 33 днів) циклом: наприклад, серед обстежених медсестер, які часто працюють нічним зсувом, 60% від нього стали коротшими (25 днів), а близько 70% скаржаться на невдачі. У щурів з порушеннями овуляції знижується толерантність глюкози та чутливість до інсуліну. Встановлено, що постійне освітлення збільшує поріг чутливості гіпоталаму до пригніченої дії естрогену. Цей механізм є запорукою старіння репродуктивної системи, як у жіночих щурів, так і у жінок. Отже, вплив світла вночі призводить до ануляції і прискореного відключення репродуктивної функції в гризунів і до дисменореї у жінок.
 ,00 Р
,00 Р
Рис. 6. Сонячний спектр і чутливість ретинальних клітин - конусів (колірна крива) і стрижнів - для світла різних хвильових довжин
Впливаючи на постійне світло посилює окислення ліпідів у тканинах тварин і зменшує загальну антиоксидантну і надоксидну дисмутазу активність, в той час як використання метаніну пригнічує окислення ліпідів, особливо в мозку. Підтверджено антиоксидантну дію мелатоніна, виявлених Р. Реутерами у 1993 році. Основна увага цієї дії гормону є захистом ядерної ДНК, білків і ліпідів, що проявляється в будь-якій клітині живого організму і по відношенню до всіх клітинних структур. антиоксидантна активність мелатоніна пов'язана з його здатністю нейтралізувати вільні радикали, в тому числі утворилися при окисленні ліпідів, а також при активації глутатіоневої пероксидази - потужний ендогенний фактор ферментативного захисту від радикального окислення. У ряді експериментів, доведено, що мелатонін нейтралізує гідроксиль радикали більш активно, ніж антиоксиданти, такі як глуатіон і маннітол, а для пероксидних радикалів він двічі міцний, як вітамін Е.
Робота та здоров’я Зараз, в деяких галузях промисловості, кількість людей, які працюють у зміщеннях, є досить значним: наприклад, в Сполучених Штатах вони 20%, а в більшості країн Європейського економічного співтовариства – 15-20% від загальної. Зрозуміло проблеми здоров'я серед працівників зсуву включають порушення сну, обмін речовин і толерантність до ліпідів, захворювання шлунково-кишкового тракту, збільшення частоти серцево-судинних захворювань, а можливо, розвиток діабету. У цій групі часто частіше, ніж в робочих день зрушень, ожиріння, високий рівень тригліцеридів і холестерину, спостерігається низька концентрація ліпопротеїнів високої щільності. З іншого боку, є докази, що такий метаболічний синдром служить фактором ризику не тільки для серцево-судинних захворювань, але і для злоякісних пухлин.
У зв’язку з висновками новоутворень, у зв’язку з переходом працівників з щонайменше 10 років досвіду, у порівнянні з денними працівниками. У Данії велике дослідження (близько 7000 осіб в кожній групі) показали, що вечірня робота значно збільшила ризик раку грудей у жінок віком від 30 до 54 років. Схожі спостереження відзначили у Фінляндії та США в огляді учасників польотів на рак грудей. Раковий ризик також був знайдений для збільшення безсоніжної безсоння, збільшення нічного освітлення та нічного зсуву. В останньому випадку ризик також збільшений з довжиною сервісу (до 2). У Норвегії при аналізі даних про здоров'я майже 45,000 медсестер, було встановлено, що показник додаткового ризику раку грудей у тих, хто працював вночі протягом 30 років або більше був 2.21. У довгострокових нічних працівниках Сіетл було знайдено аналогічну картину щодо раку товстої кишки. Дані були отримані на підвищеному ризику раку кишки та прямої кишки у жінок, що працюють на радіо та телеграфі.

У 2003 році Е. Щернхаммер та її колеги проаналізували дані про здоров’я 79 000 медсестри та виявили, що працівники нічного перемикання мають більш високий ризик раку груди. Колонні та ректальні раки є більш поширеними у людей, які мають щонайменше три нічні зміни на місяць протягом 15 років або більше. Послідовні пілоти авіакомпанії Nordic повідомляють про підвищений ризик раку простати в залежності від кількості тривалих рейсів. Механізми, що зазначають підвищений ризик раку серед нічних працівників та екіпажів польоту, можуть бути пов'язані з порушенням ритмів циркадії та вимушеного впливу світла вночі, що призводить до зменшення виробництва мелатонину, відомий біологічний блокатор карциногенезу.
Вплив на світло-карциногенез Повернувшись у 1964 році, німецький дослідник W. Jochle зазначив, що в мишей з цілодобовим освітленням кількість матових пухлин і загибель, викликаних ними, значно більше, ніж у тварин при нормальному режимі. Для інших новоутворень спостерігається схожий візерунок. У 1966 році співробітник Московського Центру досліджень раку І.О. Смірнова відкрився гіперпластичні процеси в молочній залозі та маститітіті в 78-88% щурів жінок через 7 місяців після настання впливу постійного світла. За даними І.А. Виноградова, при зберіганні щурів під постійним освітленням, трохи більше половини жінок живуть до 18 місяців, в той час як майже 90% тварин були живими за цей час в кімнаті з стандартним режимом освітлення. У 30% щурів, що зберігалися під постійним світлом, у порівнянні з 16% за стандартним режимом.
У експериментах, проведених в нашій лабораторії Д.А. Батурина, жіночий мишей, що носить ген раку грудей ХЕР-2/ней, значно більше грудних аденокарцином в результаті постійного освітлення порівняно з тими стандартними умовами. Ефект був пропорційний інтенсивності освітлення. Вплив постійного світла значно прискорить вікову репродуктивну дисфункцію та значно підвищує спонтанний карциногенез у мишей КБА. Безперервне освітлення стартувало в 30-ти деноккарциномах в щурах BDII/Han.
У 1965 році І.К. Хаецький з Київського інституту онкологічних проблем вперше повідомив про стимулювання впливу постійного освітлення на корциногенез молочних залоз у щурів, викликаних введенням 7.12-диметилбензантрацене (ДМБА). При зберіганні тварин при постійному або стандартному освітленні кількість аденокарциномів ссавців у щурів, які отримували DMBA у віці від 55 днів, становить 95 і 60%, відповідно. Застосування мелатонину значно затримала розвиток індукованих пухлин в обох групах.
У наших експериментах введення ще одного карциногену, N-nitrosometylurea (NMM), до щурів, що зберігаються в нормальних умовах, привели до появи аденокарциномів ссавців в 55% тварин. При постійному освітленні кількість цих новоутворень значно зросла, а період їх затримки знизився. У таких щурів концентрація пролактину збільшена вночі в сироватці крові, а вміст мелатонину знизився порівняно з аналогічними показниками у щурів за стандартними умовами.
У роботі Французьких дослідників було показано, що порушення ритмів циркадіанів у щурів, викликаних постійним світлом, стимульованого карциногенезу в печінці, індукованої N-нітродіаетиламіном. Панченко А.В. також зазначив, що при постійному освітленні у щурів збільшено кількість аденокарциномів в захваті та нащадних частинах товстої кишки з введенням 1,2-диметилгідразину (ДМГ) порівняно з щурами, що зберігаються в стандартних умовах, а також отримали ін'єкції цього карциногену.

Разом з Д.С. Беніашвілі, ми вивчили ефект постійного освітлення на трансмісцевому карциногенезі, індукованого N-нітроетилом. В кімнаті з цілодобовою подачею, після чого щури перенесли в нормальний режим. Виявилося, що навіть короткостроковий вплив постійного світла стимулює зростання індукованих новоутворень нервової системи і нирок в потомленні порівняно з потомою щурів в стандартних умовах. Таким чином, постійне освітлення активізує пухлини, індуковані хімічними карциногенами різної локалізації.
Останнім часом у пацієнтів з раком грудей (на 95% випадків), внесені зміни у активність три годинникових генів (ПЕР1, ПЕР2, ПЕР3). Це може призвести до порушення контролю нормального циркаського ритму і, таким чином, збільшити виживання ракових клітин і підвищити неопластичний процес. В даний час не зрозуміло, що ген Per2 унікальний як «пухлинний пригніч» або чи є інші годинникові гени з аналогічною протипухлинною функцією. Механізм пригнічення пухлинного зростання також незнімний, але є важливим спостереженням – ракова тканина обов’язково пов’язана з особливими годинниковими генами. У 2006 році було опубліковано шість досліджень, які показали порушення функцій добових генів у онкологічних пацієнтів ряду інших локалізацій.
Дані, отримані у щурів і людей, показують, що як пухлини, так і особи значно змінюють ритми циркаді. Отже, в наших експериментах у щурів з раку товстої кишки, викликаних 1,2-диметилгідраззином, циркадним ритмом мелатоніну в сироватці, при активності сосновихцитів і вмісту біогенних амінів в сапрахімічному ядрі гіпоталаму і преоптичного регіону. Таким чином, екологічні та генетичні чинники, які пошкоджують системний та/або місцевий циркадіальний ритм може порушити тимчасове регулювання клітинного поділу та підвищують пухлинний ріст.
Антистресові ефекти мелатоніна Епіфіз є важливим елементом антистресу «захисту» тіла, і мелатонін відіграє важливу роль в цьому неспецифічному факторі захисту. У високоорганічних тварин і особливо людей негативні емоції слугують стартовою точкою в розвитку стресу. Мелатонін знижує емоційну реактивність. Негативні наслідки стресу включають збільшення вільного радикального окислення, включаючи окислення ліпідів, які пошкоджують клітинні мембрани. Стрес обов'язково супроводжується широкими зсувами в ендокринній сфері, які в першу чергу впливають на гіпоталаміко-гіпофізну систему. Участь мелатоніна – «коррективний» в природі: гормон підключений до ендокринного регулювання тільки при гострих відхиленнях в роботі надниркових залоз.
Є цілий ряд доказів для несприятливих наслідків хронічного стресу на імунітеті. Зокрема, у людей, які переживали травматичну ситуацію протягом тривалого часу, рівень Т-лімфоцитів в крові знижується. У цій ситуації мелатонін має прямий вплив на імунокомпетентні клітини та непрямо через гіпоталамус та інші нейроендокринні структури.
Хронічний стрес (наприклад, пов'язаний з болем або іммобілізаціям) викликає невідповідність добових біоритмів, при цьому виникають проблеми зі сном, змінами ЕЕГ, секретністю ряду біологічно активних сполук порушується. І хоча основну «воду ритму» в організмі не є епіфізісом, але супречиманую нуклею гіпоталаму, як з цих утворень взаємодіють через медіацію мелатонину (до неї відносяться в клітинах CCN), які здатні обмежити перебіг «закінченого годинника» основного ритмічного драйвера.
Мелатонін, старіння та пухлинний розвиток Отже, в експериментах з тварин з індукованим хімічним карциногенезом, мелатонін пригнічував зростання пухлин різної локалізації (момілярна залоза, цервік і вагіна, шкіра, підшкірна тканина, легені, ендометрію, печінку, товста кишка), що свідчить про широкий спектр її антикарциногенної дії. Результати цих експериментів з тварин добре відповідають результатами клінічних спостережень. Отже, канадські дослідники підвели підсумки 10 досліджень, які використовували мелатонін для лікування онкологічних пацієнтів з твердими формами пухлин. У 643 пацієнтів, які приймають мелатонін, відносний ризик смерті знизився до 0,66, без серйозних побічних ефектів, що повідомляються протягом року.

Нещодавно активно обговорювалися можливі механізми інгібіторного ефекту мелатонину на карциногенезі та старіння. Виявлено, що на системних, тканинних, клітинних та підклітинних рівнях (Таблиця 3), запобігаючи старінню та онкологічних захворюваннях. На системному рівні мелатонін знижує вироблення гормонів, які сприяють цим процесам, стимулює імунне відеоспостереження, запобігає розвитку метаболічного синдрому. При цьому активовано виробництво вільних кисневих радикалів і антиоксидантного захисту. Мелатонін пригнічує проліферативну активність клітин і підвищує рівень апоптозу при пухлинах, але знижує її в нервовій системі, гальмує активність теломерази. На генетичному рівні вона гальмує дію мутагенів і каліогенів, а також вираз онкогенів (рис. 7).
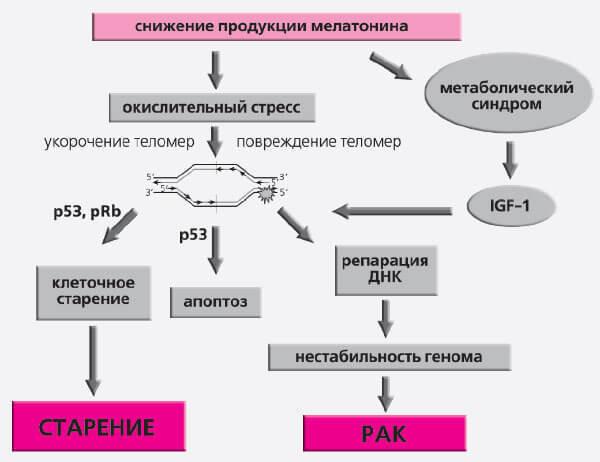
Рис. 7. Молекулярні механізми впливу світла і мелатоніна на старіння і рак
Всі ці дані вказують на важливу роль епіфізу в розвитку раку. Пригнічення його функції при постійному освітленні стимулює карциногенез. Епідеміологічні спостереження щодо підвищеного ризику розвитку грудей і раку товстої кишки в нічних зсувних працівників відповідають результатам стержняних експериментів. Застосування епіфізеального гормону гальмує карциногенез у тварин як в нормальному режимі, так і в постійному освітленні. Мелатонін може бути дуже ефективним для профілактики раку, особливо в північних регіонах, де завжди світло влітку («білі ночі»), і під час довгої полярної ночі, електричний світло всюди.
На відміну від багатьох гормонів, вплив мелатонину на клітинні структури залежить не тільки від його концентрації в крові і міжклітинному середовищі, але і на початковому стані клітини. Це дозволяє розглянути мелатонін універсальний ендогенний адаптоген, який підтримує баланс тіла на певному рівні і сприяє адаптації до постійно мінливих умов навколишнього середовища і локальних впливів на організм.
В даний час багато країн виробляють препарати мелатонін, які зареєстровані як лікарські препарати або як харчові добавки. Сьогодні в лікуванні різних захворювань, в першу чергу при порушеннях сну, виразкової хвороби шлунка і дванадцятипалої кишки, гіпертонії.
Чисельні дослідження показали, що мелатонін уповільнює процес старіння і збільшує тривалість життя лабораторних тварин - плодових пластівців, плоских черв'яків, мишей, щурів. Деякі оптимізми викликані публікаціями про свою здатність підвищити стійкість до окислювального стресу і ослаблення проявів деяких вікових захворювань людей, таких як ретинальна макулярна дегенерація, хвороба Паркінсона, хвороба Альцгеймера, гіпертонія, цукровий діабет. Комплексні клінічні дослідження цього гормону значно розширять його застосування в лікуванні і профілактиці вікових захворювань і, в кінцевому рахунку, передчасному старінню. Видання
Автор В. Н. Анізомов, доктор медичних наук
Потужність материнського або нових відкриттів епігенетики
Хімія тіла: окситоцин – гормон довіри
P.S. І пам'ятайте, що просто змініть наше споживання – разом ми змінюємо світ!
Приєднуйтесь до нас на Facebook, VKontakte, Odnoklassniki
Джерело: view-w.ru/2016/04/09/xronometr-zhizni-otchego-my-stareem/
Переглядають палички як тіні.
Але якщо сонце спить вночі,
Чи варто час?
Вся історія ідей і концептів в геронології можна коротко описати як історія пошуку «розблокування» старіння. У різні часи, як були присутні такі «години». ендокрин- боги, надниркові залози, щитовидна залоза, гіпофіз.
Відомий вітчизняний геронтолог В.М. Дільман вважає, що час життя нараховує головний «провідник» ендокринного оркестру, розташований на базі мозку. Гіпоталамусй
У той же час в природі є природний механізм, який визначає всі ритми живих організмів - це зміна дня і ночі, світла і темряви. Поворот нашої планети навколо його осі і одночасно навколо Сонця вимірює календарний день, сезони і роки, з якими його мешканці порівнювати тривалість життя.
Природа забезпечила живі організми з пристроєм, здатним процвітати інформацію світла і перетворювати її в сигнали, які контролюють ритми тіла. Центральна частина даного пристрою – верхня придатка мозку, епіфізіс.
Стародавні анатомісти назвали його сосновою залозою для її розкладання до соснового конуса. Субстантивна функція епіфізисТрансмісія інформації про світлий режим навколишнього середовища в внутрішньому середовищі тіла.
Таким чином, організм зберігає фізіологічні ритми, які забезпечують адаптацію до умов навколишнього середовища. У рибі, амфібії, рептилій і птахів, світло проходить через тонкий череп, а епіфізі має можливість безпосередньо сприймати світлові сигнали (запобігає тому, що це називається «третя око».

Рис. 1. Структурна формула мелатоніна
У ссавців світло інформації, що сприймається спеціальними клітинами сітківки головиh передається до епіфізісу за допомогою нейронів сапрахімічної нуклеї (SCN) гіпоталамусу через стовбур верхньої грудної частини хребта і симпатических нейронів верхньої шийної ромашки. У темряві сигнали з СНЗ підвищують синтез і випуск норепінафрину з симпатичних закінчень.
У свою чергу, це нейротрансмітент збуджує рецептори, які знаходяться на мембрані клітин епіфізісу (сосновіоцити), стимулюючи синтез мелатонін (рис. 1). Цей головний гормон епіфізісу є похідним біогенного аміну, серотоніну, утвореного з амінокислотного триптофану, що надходить з їжі. Діяльність ферментів, залучених до перетворення серотоніну на мелатонін, пригнічує освітленням. Саме тому цей гормон синтезується вночі, коли його рівень в крові максимальний, а вранці і вдень години мінімальний (рис. 2).

Рис. 2. Біосинтез і щоденний ритм мелатонін
У тілі є також екстрапреналін (формування поза епіфізом) Українськийй Це відкриття належить російським дослідникам Н.Т. Рейхлін і І.М. Квітний: у 1974 році вони виявили, що мелатонін синтезується в клітинах кишкової добавки. Потім вийшов, що цей гормон утворюється в інших частинах шлунково-кишкового тракту, в багатьох інших органах - печінці, нирки, наднирковий жовчний міхур, яєчники, ендометрію, плаценти, тимусу, а також в лейкоцитах, тромбоцитах і ендотелію.
Біологічний ефект екстрапінальної мелатоніну здійснюється безпосередньо там, де він утворюється. Синтез гормонів негормональних клітин підтверджує гіпотезу еволюціональної давнининини гормонів, які, очевидно, з'являються навіть перед ізоляцією ендокриновних залоз. Питання про те, чи є цей шлях синтезу гормонів - фотонезалежний ще не був остаточно вирішений.
Режим світла, мелатонін та регуляція добових біоритмів Якщо епіфізі подобаються біологічним годинником тіла, то мелатонін можна порівняти з педулу, зниженням амплітуди коливань яких призводить до зупинки цих годинників. Ймовірно, це більш точне, щоб подобатися епіфізісу на сонник, в якому мелатонін грає роль тіні від гнома - стрижень, який відливає тінь з сонця. Під час дня сон є високим і тінь коротким (рівень мельатонін мінімальний), в середині ночі - пік синтезу мелатонину епіфізісом і його секреції в кров. Важливо, що мелатонін має циркадний ритм, тобто блок його вимірювання є щоденним обертанням Землі навколо його осі.
Всі біологічні ритми строго обіймають головним водієм, розташованим в супречичному нулі гіпоталаму. Молекулярний механізм формується генами «clock» (Per1, Per2, Per3, Cry-1, Cry-2, Годинники, Bmal1/Mop3, Тим тощо). Показано, що світло безпосередньо впливає на роботу тих з них, які забезпечують циркадський ритм. Ці гени регулюють активність генів ключових клітинних циклів поділу і генів апоптозу. Інфекційний гормон, який передає гідуючі сигнали до органів і тканин, по суті, мелатонін.
Характер відповіді регулюється не тільки своїм рівнем в крові, але і тривалістю відвертого секрету. Крім того, мелатонін надає адаптацію ендогенних біоритмів для постійно мінливих умов навколишнього середовища (рис. 3). Регуляторна роль цього гормону є універсальним для всіх живих організмів, про що свідчить наявність і чіткий ритм синтезу у всіх тварин, починаючи з одноклітинних.

Рис. 3. Синхронізація біоритмів
Завдяки амфіфіфіфільним властивостям (розчинається в воді і жирах), мелатонін долає всі тканинні бар’єри, вільно проходить через клітинні мембрани. Обхід системи рецепторів та сигналізації молекул, взаємодіє з ядерними та мембранними рецепторами, впливає на внутрішньоклітинні процеси. Мелатонін рецептори знаходять в різних ядерах гіпоталаму, сітківці очей та інших тканинах нейрогенної та іншої природи.
У здорових дітей концентрація мелатонину в крові поступово підвищується до року і залишається на досить високому рівні до опуклості. У юних дітей кількість мелатоніна вночі становить близько 40 разів вище, ніж протягом дня. У молодих дітей цей гормон виконує дві функції: продовжує сон і пригнічує секрецію статевих гормонів. Під час статевих губ кількість циркулюючих гормонів в крові знижується, і найбільш чітко під час статевих губ. Відмінність концентрацій нічного та дня скорочена до 10 разів. Визначено, що діти з затримкою статевих губ мають вищі рівні мелатонін. Якщо вміст гормонів продовжує бути високим (five або більше разів вище норми віку), статеві губи затримуються протягом тривалого часу.
Це, ймовірно, через мелатонін, що у дорослих є еротичні мрії. Не без участі, що сон переходить в «рапідний етап» (пардоксичний сон) і яскравий емоційний досвід приходять до життя пам'яті, в тому числі пов'язаних з сексом. У людей віком 60-74 років більшість фізіологічних показників перенесли позитивний фазовий зсув ритму цирккадного ритму близько 1,5-2 годин попереду. У осіб понад 75 років, десинхронізація секрету багатьох гормонів, температури тіла, сну та певних ритмів поведінки часто виникає, що може бути пов'язана з епіфізісом, функція якої пригнічує старінням (рис. 4).

Рис. 4. Щоденний ритм концентрації мелатонін (pg / мл) в крові чоловіків різного віку. На осі координати - мелатонін, рг / мл; на абссисці - час доби, ч.
Якщо епіфізіс є сонцем тіла, то будь-які зміни тривалості денного світла повинні вплинути на його функції і, в кінцевому підсумку, швидкість старіння. У ряді робіт показано, що порушення фотоперіодності може істотно зменшити тривалість життя. Американські дослідники М. Хард і М. Ральф виявили, що золоті хамстери з спеціальною мутацією в гені тау відповідають за вироблення ритмічних сигналів в сапрахімічному ядрі гіпоталамусу жив 20% менше, ніж контрольні. При відновленні головного мозку хамстерів імплантованих клітин гіпоталамусу від здорових тварин, відновлена тривалість життя. У руйнуванні супрахиматичних ядер призводить до зменшення тривалості життя тварин. Порушення функції деяких циркадних генів викликає передчасне старіння і розвиток різних патологічних станів, в тому числі підвищення чутливості мишей до розвитку пухлин (до 1).
 р.
р.Репродуктивна функція Після винаходу електричного освітлення, нічний світ (попередньо, як легкий забруднення) став важливою частиною сучасного способу життя (рис 5), що веде до серйозних поведінкових та здорових порушень, включаючи серцево-судинні захворювання та рак. Згідно гіпотези «крикадного руйнування», така зміна режиму світла порушує ендогенний добовий ритм, пригнічує пригнічену секрецію мелатоніну і зменшує її концентрацію в крові. Уважно проведені дослідження показали, що освітлення 1.3-4.0 люкс монохромного синього світла або 100 люкс білого світла пригнічує виробництво мелатонину епіфізісом (рис. 6).

Рис. 5. Перегляд Землі з космосу вночі
У лабораторних гризунів штучне збільшення тривалості світлового періоду на 2-4 години продовжує тривалість циклу естра (овуляції) і в деяких випадках порушує його. З постійним (24 годин / день) вплив світла в більшості мишей і щурів дуже швидко настає стан, еквівалентний меніпоузи у жінок. У яєчників таких тварин виявлено кісти і гіперплазія клітин, що виробляють статеві гормони. Замість циклічної секреції гонадотропінів, пролактин, естроген і прогестерон характерний для нормального репродуктивного періоду, ці гормони утворюються ациклічно, що викликає гіперпластичні процеси в молочних залозах і матці. Доведено про те, що вплив світла вночі знижує тривалість менструального циклу у жінок з тривалим (більше 33 днів) циклом: наприклад, серед обстежених медсестер, які часто працюють нічним зсувом, 60% від нього стали коротшими (25 днів), а близько 70% скаржаться на невдачі. У щурів з порушеннями овуляції знижується толерантність глюкози та чутливість до інсуліну. Встановлено, що постійне освітлення збільшує поріг чутливості гіпоталаму до пригніченої дії естрогену. Цей механізм є запорукою старіння репродуктивної системи, як у жіночих щурів, так і у жінок. Отже, вплив світла вночі призводить до ануляції і прискореного відключення репродуктивної функції в гризунів і до дисменореї у жінок.
 ,00 Р
,00 РРис. 6. Сонячний спектр і чутливість ретинальних клітин - конусів (колірна крива) і стрижнів - для світла різних хвильових довжин
Впливаючи на постійне світло посилює окислення ліпідів у тканинах тварин і зменшує загальну антиоксидантну і надоксидну дисмутазу активність, в той час як використання метаніну пригнічує окислення ліпідів, особливо в мозку. Підтверджено антиоксидантну дію мелатоніна, виявлених Р. Реутерами у 1993 році. Основна увага цієї дії гормону є захистом ядерної ДНК, білків і ліпідів, що проявляється в будь-якій клітині живого організму і по відношенню до всіх клітинних структур. антиоксидантна активність мелатоніна пов'язана з його здатністю нейтралізувати вільні радикали, в тому числі утворилися при окисленні ліпідів, а також при активації глутатіоневої пероксидази - потужний ендогенний фактор ферментативного захисту від радикального окислення. У ряді експериментів, доведено, що мелатонін нейтралізує гідроксиль радикали більш активно, ніж антиоксиданти, такі як глуатіон і маннітол, а для пероксидних радикалів він двічі міцний, як вітамін Е.
Робота та здоров’я Зараз, в деяких галузях промисловості, кількість людей, які працюють у зміщеннях, є досить значним: наприклад, в Сполучених Штатах вони 20%, а в більшості країн Європейського економічного співтовариства – 15-20% від загальної. Зрозуміло проблеми здоров'я серед працівників зсуву включають порушення сну, обмін речовин і толерантність до ліпідів, захворювання шлунково-кишкового тракту, збільшення частоти серцево-судинних захворювань, а можливо, розвиток діабету. У цій групі часто частіше, ніж в робочих день зрушень, ожиріння, високий рівень тригліцеридів і холестерину, спостерігається низька концентрація ліпопротеїнів високої щільності. З іншого боку, є докази, що такий метаболічний синдром служить фактором ризику не тільки для серцево-судинних захворювань, але і для злоякісних пухлин.
У зв’язку з висновками новоутворень, у зв’язку з переходом працівників з щонайменше 10 років досвіду, у порівнянні з денними працівниками. У Данії велике дослідження (близько 7000 осіб в кожній групі) показали, що вечірня робота значно збільшила ризик раку грудей у жінок віком від 30 до 54 років. Схожі спостереження відзначили у Фінляндії та США в огляді учасників польотів на рак грудей. Раковий ризик також був знайдений для збільшення безсоніжної безсоння, збільшення нічного освітлення та нічного зсуву. В останньому випадку ризик також збільшений з довжиною сервісу (до 2). У Норвегії при аналізі даних про здоров'я майже 45,000 медсестер, було встановлено, що показник додаткового ризику раку грудей у тих, хто працював вночі протягом 30 років або більше був 2.21. У довгострокових нічних працівниках Сіетл було знайдено аналогічну картину щодо раку товстої кишки. Дані були отримані на підвищеному ризику раку кишки та прямої кишки у жінок, що працюють на радіо та телеграфі.

У 2003 році Е. Щернхаммер та її колеги проаналізували дані про здоров’я 79 000 медсестри та виявили, що працівники нічного перемикання мають більш високий ризик раку груди. Колонні та ректальні раки є більш поширеними у людей, які мають щонайменше три нічні зміни на місяць протягом 15 років або більше. Послідовні пілоти авіакомпанії Nordic повідомляють про підвищений ризик раку простати в залежності від кількості тривалих рейсів. Механізми, що зазначають підвищений ризик раку серед нічних працівників та екіпажів польоту, можуть бути пов'язані з порушенням ритмів циркадії та вимушеного впливу світла вночі, що призводить до зменшення виробництва мелатонину, відомий біологічний блокатор карциногенезу.
Вплив на світло-карциногенез Повернувшись у 1964 році, німецький дослідник W. Jochle зазначив, що в мишей з цілодобовим освітленням кількість матових пухлин і загибель, викликаних ними, значно більше, ніж у тварин при нормальному режимі. Для інших новоутворень спостерігається схожий візерунок. У 1966 році співробітник Московського Центру досліджень раку І.О. Смірнова відкрився гіперпластичні процеси в молочній залозі та маститітіті в 78-88% щурів жінок через 7 місяців після настання впливу постійного світла. За даними І.А. Виноградова, при зберіганні щурів під постійним освітленням, трохи більше половини жінок живуть до 18 місяців, в той час як майже 90% тварин були живими за цей час в кімнаті з стандартним режимом освітлення. У 30% щурів, що зберігалися під постійним світлом, у порівнянні з 16% за стандартним режимом.
У експериментах, проведених в нашій лабораторії Д.А. Батурина, жіночий мишей, що носить ген раку грудей ХЕР-2/ней, значно більше грудних аденокарцином в результаті постійного освітлення порівняно з тими стандартними умовами. Ефект був пропорційний інтенсивності освітлення. Вплив постійного світла значно прискорить вікову репродуктивну дисфункцію та значно підвищує спонтанний карциногенез у мишей КБА. Безперервне освітлення стартувало в 30-ти деноккарциномах в щурах BDII/Han.
У 1965 році І.К. Хаецький з Київського інституту онкологічних проблем вперше повідомив про стимулювання впливу постійного освітлення на корциногенез молочних залоз у щурів, викликаних введенням 7.12-диметилбензантрацене (ДМБА). При зберіганні тварин при постійному або стандартному освітленні кількість аденокарциномів ссавців у щурів, які отримували DMBA у віці від 55 днів, становить 95 і 60%, відповідно. Застосування мелатонину значно затримала розвиток індукованих пухлин в обох групах.
У наших експериментах введення ще одного карциногену, N-nitrosometylurea (NMM), до щурів, що зберігаються в нормальних умовах, привели до появи аденокарциномів ссавців в 55% тварин. При постійному освітленні кількість цих новоутворень значно зросла, а період їх затримки знизився. У таких щурів концентрація пролактину збільшена вночі в сироватці крові, а вміст мелатонину знизився порівняно з аналогічними показниками у щурів за стандартними умовами.
У роботі Французьких дослідників було показано, що порушення ритмів циркадіанів у щурів, викликаних постійним світлом, стимульованого карциногенезу в печінці, індукованої N-нітродіаетиламіном. Панченко А.В. також зазначив, що при постійному освітленні у щурів збільшено кількість аденокарциномів в захваті та нащадних частинах товстої кишки з введенням 1,2-диметилгідразину (ДМГ) порівняно з щурами, що зберігаються в стандартних умовах, а також отримали ін'єкції цього карциногену.

Разом з Д.С. Беніашвілі, ми вивчили ефект постійного освітлення на трансмісцевому карциногенезі, індукованого N-нітроетилом. В кімнаті з цілодобовою подачею, після чого щури перенесли в нормальний режим. Виявилося, що навіть короткостроковий вплив постійного світла стимулює зростання індукованих новоутворень нервової системи і нирок в потомленні порівняно з потомою щурів в стандартних умовах. Таким чином, постійне освітлення активізує пухлини, індуковані хімічними карциногенами різної локалізації.
Останнім часом у пацієнтів з раком грудей (на 95% випадків), внесені зміни у активність три годинникових генів (ПЕР1, ПЕР2, ПЕР3). Це може призвести до порушення контролю нормального циркаського ритму і, таким чином, збільшити виживання ракових клітин і підвищити неопластичний процес. В даний час не зрозуміло, що ген Per2 унікальний як «пухлинний пригніч» або чи є інші годинникові гени з аналогічною протипухлинною функцією. Механізм пригнічення пухлинного зростання також незнімний, але є важливим спостереженням – ракова тканина обов’язково пов’язана з особливими годинниковими генами. У 2006 році було опубліковано шість досліджень, які показали порушення функцій добових генів у онкологічних пацієнтів ряду інших локалізацій.
Дані, отримані у щурів і людей, показують, що як пухлини, так і особи значно змінюють ритми циркаді. Отже, в наших експериментах у щурів з раку товстої кишки, викликаних 1,2-диметилгідраззином, циркадним ритмом мелатоніну в сироватці, при активності сосновихцитів і вмісту біогенних амінів в сапрахімічному ядрі гіпоталаму і преоптичного регіону. Таким чином, екологічні та генетичні чинники, які пошкоджують системний та/або місцевий циркадіальний ритм може порушити тимчасове регулювання клітинного поділу та підвищують пухлинний ріст.
Антистресові ефекти мелатоніна Епіфіз є важливим елементом антистресу «захисту» тіла, і мелатонін відіграє важливу роль в цьому неспецифічному факторі захисту. У високоорганічних тварин і особливо людей негативні емоції слугують стартовою точкою в розвитку стресу. Мелатонін знижує емоційну реактивність. Негативні наслідки стресу включають збільшення вільного радикального окислення, включаючи окислення ліпідів, які пошкоджують клітинні мембрани. Стрес обов'язково супроводжується широкими зсувами в ендокринній сфері, які в першу чергу впливають на гіпоталаміко-гіпофізну систему. Участь мелатоніна – «коррективний» в природі: гормон підключений до ендокринного регулювання тільки при гострих відхиленнях в роботі надниркових залоз.
Є цілий ряд доказів для несприятливих наслідків хронічного стресу на імунітеті. Зокрема, у людей, які переживали травматичну ситуацію протягом тривалого часу, рівень Т-лімфоцитів в крові знижується. У цій ситуації мелатонін має прямий вплив на імунокомпетентні клітини та непрямо через гіпоталамус та інші нейроендокринні структури.
Хронічний стрес (наприклад, пов'язаний з болем або іммобілізаціям) викликає невідповідність добових біоритмів, при цьому виникають проблеми зі сном, змінами ЕЕГ, секретністю ряду біологічно активних сполук порушується. І хоча основну «воду ритму» в організмі не є епіфізісом, але супречиманую нуклею гіпоталаму, як з цих утворень взаємодіють через медіацію мелатонину (до неї відносяться в клітинах CCN), які здатні обмежити перебіг «закінченого годинника» основного ритмічного драйвера.
Мелатонін, старіння та пухлинний розвиток Отже, в експериментах з тварин з індукованим хімічним карциногенезом, мелатонін пригнічував зростання пухлин різної локалізації (момілярна залоза, цервік і вагіна, шкіра, підшкірна тканина, легені, ендометрію, печінку, товста кишка), що свідчить про широкий спектр її антикарциногенної дії. Результати цих експериментів з тварин добре відповідають результатами клінічних спостережень. Отже, канадські дослідники підвели підсумки 10 досліджень, які використовували мелатонін для лікування онкологічних пацієнтів з твердими формами пухлин. У 643 пацієнтів, які приймають мелатонін, відносний ризик смерті знизився до 0,66, без серйозних побічних ефектів, що повідомляються протягом року.

Нещодавно активно обговорювалися можливі механізми інгібіторного ефекту мелатонину на карциногенезі та старіння. Виявлено, що на системних, тканинних, клітинних та підклітинних рівнях (Таблиця 3), запобігаючи старінню та онкологічних захворюваннях. На системному рівні мелатонін знижує вироблення гормонів, які сприяють цим процесам, стимулює імунне відеоспостереження, запобігає розвитку метаболічного синдрому. При цьому активовано виробництво вільних кисневих радикалів і антиоксидантного захисту. Мелатонін пригнічує проліферативну активність клітин і підвищує рівень апоптозу при пухлинах, але знижує її в нервовій системі, гальмує активність теломерази. На генетичному рівні вона гальмує дію мутагенів і каліогенів, а також вираз онкогенів (рис. 7).

Рис. 7. Молекулярні механізми впливу світла і мелатоніна на старіння і рак
Всі ці дані вказують на важливу роль епіфізу в розвитку раку. Пригнічення його функції при постійному освітленні стимулює карциногенез. Епідеміологічні спостереження щодо підвищеного ризику розвитку грудей і раку товстої кишки в нічних зсувних працівників відповідають результатам стержняних експериментів. Застосування епіфізеального гормону гальмує карциногенез у тварин як в нормальному режимі, так і в постійному освітленні. Мелатонін може бути дуже ефективним для профілактики раку, особливо в північних регіонах, де завжди світло влітку («білі ночі»), і під час довгої полярної ночі, електричний світло всюди.
На відміну від багатьох гормонів, вплив мелатонину на клітинні структури залежить не тільки від його концентрації в крові і міжклітинному середовищі, але і на початковому стані клітини. Це дозволяє розглянути мелатонін універсальний ендогенний адаптоген, який підтримує баланс тіла на певному рівні і сприяє адаптації до постійно мінливих умов навколишнього середовища і локальних впливів на організм.
В даний час багато країн виробляють препарати мелатонін, які зареєстровані як лікарські препарати або як харчові добавки. Сьогодні в лікуванні різних захворювань, в першу чергу при порушеннях сну, виразкової хвороби шлунка і дванадцятипалої кишки, гіпертонії.
Чисельні дослідження показали, що мелатонін уповільнює процес старіння і збільшує тривалість життя лабораторних тварин - плодових пластівців, плоских черв'яків, мишей, щурів. Деякі оптимізми викликані публікаціями про свою здатність підвищити стійкість до окислювального стресу і ослаблення проявів деяких вікових захворювань людей, таких як ретинальна макулярна дегенерація, хвороба Паркінсона, хвороба Альцгеймера, гіпертонія, цукровий діабет. Комплексні клінічні дослідження цього гормону значно розширять його застосування в лікуванні і профілактиці вікових захворювань і, в кінцевому рахунку, передчасному старінню. Видання
Автор В. Н. Анізомов, доктор медичних наук
Потужність материнського або нових відкриттів епігенетики
Хімія тіла: окситоцин – гормон довіри
P.S. І пам'ятайте, що просто змініть наше споживання – разом ми змінюємо світ!
Приєднуйтесь до нас на Facebook, VKontakte, Odnoklassniki
Джерело: view-w.ru/2016/04/09/xronometr-zhizni-otchego-my-stareem/