1118
0.3
2016-06-02
Молекулярный биолог Андрей Гудков: Рак и старость — братья-близнецы
Молекулярный биолог Андрей Гудков много лет посвятил проблемам клеточной гибели и онкологии. Он известный ученый, старший вице-президент Онкологического института имени Розвелла Парка в Баффало, автор более 200 научных работ. Совместно с компанией Михаила Могутова «Биопроцесс» занимается исследованиями, которые могут привести к созданию радикально нового класса лекарств против пока неизлечимого заболевания.
Преступные наклонности
Андрей Владимирович, почему медицина, столь далеко продвинувшаяся в решении многих проблем, пока не может справиться с таким заболеванием, как рак?
— Бывает два типа болезней. Есть недуги, обусловленные тем, что в организме что-то сломалось или засорилось, например, сердечно-сосудистые заболевания. Что такое сердечнососудистая система? Это, в сущности, водопровод: трубы и насос. Трубы могут засориться, насос — сломаться. Значит, нужно поменять насос и прочистить трубы. И сердце будет продолжать работать.

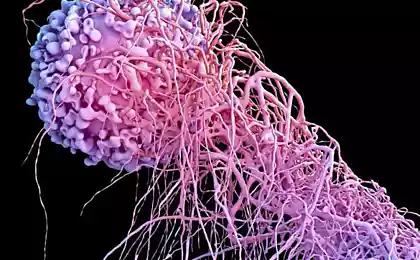
Но есть болезни, вызванные альтернативными формами жизни. К ним относятся инфекции и рак. Рак — это наши собственные клетки, которые перестали вести себя адекватно. Онкозаболевание можно сравнить с социальными недугами, например, с преступностью. Мы не можем победить рак потому же, почему не можем искоренить преступность. Злоумышленники внешне мало чем отличаются от обычных людей, они похожи на нас, к тому же виртуозно умеют уклоняться от наказания. Ровно поэтому же мы не можем избавиться от тараканов, насекомых-вредителей, крыс и мышей. Так вот рак — живой, его появление в организме вызвано не поломкой какого-то органа, а возникновением альтернативной формы жизни, которая борется за существование, правдами и неправдами избегая уничтожения, изменяясь и приспосабливаясь к лечению.
Есть ли какие-то предпосылки к тому, что будет найдено средство от этой страшной болезни?
— Перспективы победы над раком есть, и они вполне реальные. Последние сорок лет наука училась понимать рак. Болезнь перестала быть чем-то мистическим, и это очень важно. Сегодня мы уже знаем, что она связана с серией генетических или эпигенетических изменений, приобретенных редкими соматическими клетками нашего организма, которые в совокупности меняют клеточный фенотип (т.е. совокупность признаков), делают клетку все более и более эгоистичной и все менее и менее послушной законам клеточного социума.
Поясните, пожалуйста, что такое эпигенетические изменения?
— Все клетки нашего организма рождаются одинаковыми, с одним и тем же набором ДНК. Такая ситуация сохраняется и после приобретения клетками «профессий». Например, клетка-нейрон, которая живет в мозге, имеет ту же совокупность генов, что и клетки крови или кожи. Отличие клеток в том, какая часть генома доступна им для прочтения и работы. Можно сравнить ядро нашей клетки, где хранится ДНК, с библиотекой, где на полках хранится все культурное наследие человечества. Но вам доступны далеко не все книги в этой библиотеке. Какие-то стеллажи, а то и целые шкафы получают статус спецхрана. Огромные части ДНК в любой «профессиональной» клетке тоже закрыты для чтения. Поэтому клетка-нейрон не умеет синтезировать белки кожи, и наоборот, клетка кожи не производит белков нервной ткани. Получается, что хотя клетки формально одинаковы с точки зрения хранимой информации, то есть генетически идентичны, доступ к разным частям генома у них неодинаков, а значит, отличаются и свойства. Мы говорим, что они разные эпигенетически.
Но если кто-то проникнет без разрешения в спецхран и получит доступ к секретной информации, это и называется эпигенетическое событие — прочесть запретное, стать диссидентом. То есть вы приобретаете не мутацию, а возможность доступа к тем частям генома, которые в норме должны быть закрыты.
Фактически есть два механизма, с помощью которых у клетки меняется работа генома. Можно приобрести мутации, которые физически изменяют «текст» (структуру ДНК), а можно, не приобретая мутаций, изменить доступ к разным генам. Это и называется эпигенетическое изменение. И то и другое может в равной степени внести свой «вклад» в создание ракового фенотипа.
Наш организм есть социум примерно из триллиона клеток. Это профессионалы, выполняющие определенную функцию и собранные в органы и ткани. Между ними есть «договоренность» не пересекать границы своих органов. Раковые клетки нарушают это обязательство, размножаясь и создавая многочисленное потомство (рак — заболевание, которое связано с пробуждением и постепенным усилением в клетках эгоистических тенденций). В результате они образуют новый тип жизни, которая паразитически развивается в организме человека. Раковые клетки строят огромные колонии из себе подобных (первичная опухоль), а потом распространяются по всему организму, образуя поселения в неположенных местах (метастазы). Этот процесс называется прогрессией или эскалацией плохого. И снова напрашивается сравнение с преступностью. Допустим, что некая преступная группа возникает где-нибудь в Урюпинске и сначала она собирает дань только со своего города. Но с течением времени банда расширяется и начинает распространять свое влияние на всю область, затем на регион, страну, потом группировка становится международной. Так же и онкозаболевание. Рак печени сначала живет в печени. И даже когда возникают метастазы, они вначале растут как новые узлы в том же органе. Но потом появляется клетка, которая может жить и размножаться в позвоночнике или в легких. Возникает новый узел. По мере того как этот узел растет, клеткам внутри него становится душно, им не хватает кислорода. Начинается борьба за существование, естественный отбор. Только те клетки смогут выжить, которые привлекут к себе кровеносный сосуд, несущий пищу и кислород.
Казалось бы, рак должен уничтожаться иммунной системой, умеющей распознавать клетки, приобретшие новые свойства. К сожалению, больные клетки находят способы оставаться невидимыми для иммунной системы, причем каждая опухоль каждый раз «придумывает» новый способ защиты.
Рак — очень сложный фенотип, как и фенотип преступника. Нельзя стать убийцей, изменив в себе лишь одно свойство, одну черту характера. Должно поменяться мировоззрение, все жизненные ценности. Так же и в раковой клетке. Что характерно для всех людей, которые вступили на путь преступления? Их всех без исключения, таких непохожих, роднит одно — отсутствие внутреннего морального закона, оберегающего от неэтичных асоциальных поступков. Потеря совести. У каждой нормальной клетки есть механизм, который различает, хорошая она или плохая. Плохая клетка — эта, которая приобрела либо мутации, либо с ней произошли эпигенетические изменения, о которых я говорил. Тогда включается механизм, который измененную клетку наказывает. Либо ей навсегда запрещается делиться (в этом случае клетка становится сенесцентной, то есть преждевременно стареет), либо такая клетка включает программу самоубийства — апоптоз. А когда этот механизм сломан, плохие клетки вступают в борьбу за выживание. Возникает рак.
Два порока современной науки
Что мешает восстановить механизм саморегуляции клеток?
— Рак — это живой организм, который активно избегает лечения, создавая новые устойчивые к лекарствам формы. К тому же, повторюсь, не бывает двух одинаковых раков. Каждое онкологическое заболевание абсолютно уникально. Поэтому невозможно предсказать, какая комбинация свойств будет у этой версии рака, стало быть, сложно выработать тактику индивидуального лечения. Впрочем, сегодня большие надежды связываются с personalized medicine, которая будет предлагать индивидуальное лечение каждого конкретного случая.
Вообще, способы, которыми сейчас лечат рак, направлены на то, чтобы не избавиться от него, а превратить его в хроническую контролируемую болезнь. Когда мы говорим о cancer survivors (переживших рак), мы имеем в виду людей, которые не исцелились совсем, а пройдя курс лечения (или несколько), продолжают жить с этим заболеванием и, если повезет, проживут еще долго. Например, моя мама. Тридцать два года назад у нее был диагностирован рак молочной железы. Затем были сложные и тяжелые периоды лечения, на фоне которого появился новый первичный рак груди, который дал метастазы в легкие. Ситуация казалась безнадежной. Но тактика российских врачей (вот уже 25 лет лечением руководит профессор М. Личиницер из Онкологического центра им. Н.Н. Блохина) оказалась удачной.
Сегодня большие надежды возлагаются на таргетную терапию…
— Ученые, как дети, склонны мечтать. Очень хочется объявить, что найдены все ахиллесовы пяты опухолевой клетки (т.е. мишени), что все готово к выпуску лекарства против найденных мишеней, будем диагностировать их и бить по ним. Последние 10 лет все новое, что разрабатывается в качестве препаратов против рака, — это препараты таргетной терапии. Излечили ли мы хоть один рак таргетной терапией радикально? Нет. Но стало ли возможно продлить жизнь больного? Да — до тех пор, пока в недрах погибающей опухоли не возникнет очередного мутантного варианта, устойчивого к лекарству. К сожалению, в большинстве случаев речь идет всего лишь о нескольких месяцах продления жизни. Но чтобы такие лекарства создать, требуются миллиарды долларов. Поэтому и продают их за непомерные деньги.
Тупик?
— Пока нет ни одного разрешенного к применению препарата, который бы позволил вылечить, в конце концов, эту болезнь. Но хорошим примером может быть борьба со СПИДом. Медицина эту относительно простую болезнь хоть и не до конца победила, но можно утверждать, что в цивилизованных странах СПИД под контролем. Против него эффективно работает коктейль лекарств, каждое из которых бьет по своей мишени. Мутация, которая позволяет вирусу уйти от одного таргетного препарата, возникает в одной вирусной частице на миллион. А вот чтобы уйти от двух таргетных ≪стрел≫, бьющих по двум мишеням, необходима комбинация из двух мутаций. Для этого нужно уже триллион вирусных частиц. А уж если коктейль состоит из трех таргетных лекарств, то чтобы уйти от него, должно быть такое количество вирусных частиц, какое вообще нереально. Вот почему эти коктейли дают такой хороший терапевтический эффект. Но раковая клетка — не вирус, а более изощренный механизм. В ней может быть столько комбинаций разных мишеней, и они так часто меняются, что задача диагностики исключительно сложна.
В прессе много пишут о кураксинах (от английского cure — «излечивать»), нового класса препаратов. Расскажите, как были открыты эти молекулы?
— Предшествующие знания в онкологии не могли помочь создать молекулу, которая сразу била бы по нескольким мишеням. И приди я с такой задачей в любой грантовый комитет, у меня не было бы никаких шансов получить финансирование. Там посчитали бы, что это сверхамбициозный и ничем не обоснованный проект. Подобным подходам грантовые комитеты выносят обвинительный вердикт — fi shing expedition (рыбалка). Грантовые заявки все больше напоминают бизнес-план, когда от ученого требуют надежный результат и конкретные сроки. Фактически современное финансирование науки поддерживает инженерные проекты дальнейшего изучения известного, а не проекты, направленные на открытие неизвестного. Слишком рискованные, креативные проекты не финансируются. А значит, рассчитывать можно только на людей типа Михаила Могутова, не боящихся, вопреки господствующим мнениям, поверить в идею и рискнуть своими деньгами. Особенность биологии как науки состоит в том, что в ней ученый-экспериментатор не только не понимает систему до конца, но и использует это недопонимание для того, чтобы система сама ему помогла. Если идея на первый взгляд кажется малообоснованной, сумасшедшей, не стоит с ходу ее отметать, потому что сегодняшнее знание несовершенно.
Возьмем раковые клетки, которые растут в культуре ткани. Выберем такие, в которых есть две ахиллесовы пяты — две мишени. И пусть ничто в научной литературе не указывает на то, что эти мишени могут быть хоть как-то связаны, мы начинаем перебирать сотни тысяч вариантов химических соединений в поисках того, который поразит обе мишени одновременно. И оказывается, такие соединения есть! Располагая такими соединениями, можно понять, как же они работают и как две мишени все-таки связаны друг с другом. И мы открываем новый механизм! Поиск и расшифровку механизма действия кураксинов вела группа биологов, химиков и фармакологов под руководством профессора Катерины Гуровой, которая сейчас заведует лабораторией в Отделе биологии клеточного стресса Онкологического института в Баффало. Дальнейшим развитием и внедрением кураксинов в клиническую практику занимается созданная нами совместно с «Биопроцессом» биотехнологическая компания «Инкурон».
Обмануть болезнь
Есть ли какие-то еще способы победить рак?
— Я рассказал про первый способ. Бить одновременно по нескольким мишеням, как это делают наши кураксины.
Второй — выбрать универсальную мишень, которая есть в каждом без исключения случае рака, и бить по ней.
Есть такой белок MYC. Он закодирован в нашей ДНК и абсолютно необходим для пролиферации, т.е. деления, всех клеток. MYC называют онко-белком, потому что его перепроизводство в клетке ведет к опухолевой трансформации. Хотя MYC был открыт в самом начале 80-х годов, мы по-прежнему не понимаем, как он работает. Однако на основании блестящих генетических исследований лаборатории Жерарда Эванса (Gerard Evans) мы уверены, что если будет лекарство, которое блокирует MYC, то оно остановит развитие любого рака и при этом не убьет организм, хотя и заморозит процессы клеточного деления. Да, во время лечения станут тоньше стенки кишечника, кожа, остановится рост волос, упадет иммунитет. Но это обратимые изменения. А вот для большинства раковых клеток подавление MYC будет смертельным: они не могут выдержать долго без пролиферации.
Но даже таким образом мы рак полностью не вылечим. Ведь придется на время отменять лекарство, чтобы подрастить кишечник, кожу, восстановить другие ткани. Есть вероятность, что рак при этом снова пойдет в рост. Но его можно будет все время, всю жизнь держать в узде новыми курсами терапии без особого риска получить устойчивый к лечению рак: похоже, что потеря онко-белка MYC для делящейся клетки невосполнима. Это будет очень интересный препарат, который превратит рак в хроническое контролируемое заболевание. Называется этот проект АНТИМИКОН, его ведет биотехнологическая компания «Панацела Лэбз», возглавляет профессор Михаил Никифоров, другой мой коллега по отделу биологии клеточного стресса здесь, в Баффало. Финансирует проект корпорация «Роснано».
Любопытно, что MYC как мишень не оказался в фокусе больших фармацевтических компаний…
Они страдают тем же пороком, что и грантовые комитеты: как правило, не поддерживают проектов до тех пор, пока не станет понятен механизм действия лекарства.
Теперь я перехожу к самому главному. Рак возникает из комбинации генетических и/или эпигенетических изменений. Комбинация — ключевое слово. Не бывает одного генетического изменения, которого бы хватило, чтобы превратить нормальную клетку в раковую. Для клетки мышей достаточно трех событий. Для клетки человека — 4–6. Это означает, что в каждый конкретный момент времени каждый из нас, даже если мы считаемся здоровыми, носит в себе миллионы клеток, которые уже получили одну-две-три мутации. И они-то и составляют популяцию высокого риска, из которой потом, после приобретения последних недостающих изменений, и возникает рак. Если мы научимся такие клетки распознавать и время от времени уничтожать, то не из чего будет раку возникнуть.
Помня, что кураксины направлены против нескольких мишеней сразу, причем таких, которые появляются у опухолевой клетки на ранних стадиях, возникла идея использовать их для «очистки» организма от клеток высокого риска. То есть давать кураксины превентивно. Это была довольно смелая идея, и она тоже шла вразрез с общепринятой практикой применения противораковых препаратов. Вот почему. Рак сегодня лечат радиацией и химиотерапией, которые хоть и опасны для здоровых клеток, но для раковых — опаснее. В дурном сне не приснится облучать здорового человека или кормить его каким-нибудь доксорубицином или 5-фторурацилом (это — стандартные широко применяемые противораковые препараты, которые повреждают ДНК) для того, чтобы у него потом не было рака. Мы их используем только потому, что рак опаснее, чем такая терапия: мы пытаемся купить человеку несколько лет жизни, хотя и понимаем, что в случае успеха заплатим риском новых заболеваний в будущем.
Так вот кураксины не провоцируют генетических изменений клетки. А значит, есть смысл их попробовать в качестве профилактических агентов.
Мы поставили две серии долгосрочных экспериментов, взяли две модели рака: в одной рак был спровоцирован «плохой» генетикой, а в другой — химическим канцерогеном. Один опыт был поставлен в Баффало, другой — в Москве, в лаборатории профессора Марианны Якубовской в Онкологическом центре им. Н.Н. Блохина. В первом случае были взяты мыши, у которых онкоген her2 был искусственно включен в клетки молочной железы. У самок таких мышей в течение первого года жизни — а мыши живут два года — со 100% гарантией возникает рак молочной железы, и они погибают. Для второй модели были взяты здоровые мыши, но их покормили диметилгидразином. Это — компонент ракетного топлива, мощный канцероген. Подавляющее большинство однажды обработанных им мышей развивают рак одного или нескольких типов.
И генетически предрасположенные, и отравленные канцерогеном мыши, начиная с трехмесячного возраста и до самой смерти, пили воду с растворенным в ней кураксином. В момент, когда от рака молочной железы умерла последняя мышь в контрольной группе, получавшей обычную воду, большинство мышей в группе, которая получала воду с кураксином, еще не имели опухолей, и половина из них умерли от старости, а не от рака. А те опухоли, которые возникли, были менее агрессивны, чем аналогичные опухоли в контрольной группе. То же самое можно было наблюдать и в случае отравленных канцерогеном мышей: в этой модели большинство раков задержалось в развитии, и частота их уменьшилась.
То есть возможна профилактика рака?
— Профилактика преступности клеток. Если создать препараты, которые будут узнавать клетки, получившие только первые изменения, то, проводя периодические курсы «очистительной» терапии, можно снять проблему.
Рак и старость — братья-близнецы
Уровень заболеваемости раком резко возрастает к старости. Онкология и возраст действительно взаимосвязаны?
— Что такое старение? Это возникновение системного, мягкого, хронического воспаления всего организма, скорее всего, связанное с накоплением сенесцентных клеток, которые и являются источником воспаления. В этом смысле старение и рак — близнецы и братья. Одно есть следствие другого. 70% мужчин, достигших 70-летнего возраста, имеют рак простаты. А 90-летние — 90%. Поразительно, что на ранних стадиях развития таких раков даже одно снятие воспаления приводит к тому, что болезнь уходит. Так, например, может исчезнуть рак желудка ранней стадии, когда удается избавиться от Helicobacter pylory с помощью антибиотиков.
Есть, таким образом, два способа профилактики онкопроцесса. Первый способ — отличать те клетки, которые приобрели признаки «преступности» и уничтожать их, тем самым отнимая у рака саму возможность возникнуть. И второй — бороться с системными изменениями, связанными со старением, уничтожая лекарственными методами клетки — источники старческого воспаления. Эту задачу решает наша компания «Тартисстарение», также финансируемая «Биопроцессом». То есть производить периодическое омолаживание организма, решая при этом массу проблем.
Если раньше накопление сенесцентных клеток как причина старения было одной из многих теорий, то сейчас она начинает доминировать в геронтологии…
— Молекулы — прототипы будущих лекарств у нас уже есть. Мы доказали, что старческие клетки можно уничтожать, не трогая молодые, а значит, сама болезнь является поддающейся лечению. Это отправная точка. У нас есть препараты, которые отличают старую клетку от молодой, и в недалеком будущем можно ожидать их проверки на животных.
То, что наша программа борьбы со старением состоялась, — это в большой степени заслуга Михаила Могутова. Если бы не его смелость и доверие, то на момент создания этой компании получить деньги на такие исследования на биотехнологическом рынке было бы невозможно.
А похоже, риск был оправдан.
Революционные препараты: тише, идут испытания
Почему клинические испытания своих препаратов вы проводите в России, а не в Америке?
— Для исследователя самое главное — скорость. Кстати, с этим обстоятельством отчасти связана массовая миграция ученых в Америку далеко не только из России, а и из более благополучных стран: в этой стране безусловный приоритет скорости во всем. Кроме процесса развития лекарств, быстрота которого в США сдерживается жесточайшими требованиями безопасности и надежности.
Вот и получается, что довести препарат до испытаний в России быстрее, а значит, быстрее можно получить ценнейшие сведения о том, как он себя поведет на больных. И хотя полученных по российским правилам сведений будет недостаточно, чтобы обеспечить одобрение лекарства в Америке, такие сведения позволят оптимально спланировать и эффективнее провести испытания по американским стандартам. В конечном итоге выиграют все.
На какой стадии сейчас находятся испытания препаратов?
— Первый кураксин (CBLC0137) проходит клинические испытания в России. Они ведутся в нескольких медицинских центрах, и их координирует профессор С. Тюляндин из Онкоцентра им. Блохина.
Первая фаза — это определение границ применимости препарата, характеристика его поведения в человеческом организме и переносимости. И хотя всегда есть надежда, что уже в первой фазе мы сможем помочь больному, все же главная задача — доказать, что препарат не вреден, и дойти до максимальных возможных доз.
Задача второй фазы — показать позитивный эффект на больных с определенным типом рака. Естественно, начать вторые фазы испытаний будет возможно, только когда мы убедимся, что в первой фазе дошли до таких доз кураксина, от которых можно ждать эффекта. На этой стадии мы начнем также испытывать предварительно опробованные в лаборатории комбинации кураксина с традиционными препаратами.
Как я уже говорил, сходная программа испытаний начнется в Америке, где все для этого готово. В России мы используем оральную форму кураксина, в Америке — инъекционную.
Целую серию новых противораковых препаратов, основанных на других, нежели кураксины, принципах убийства опухолевой клетки, разрабатывают две другие российско-американские компании — упомянутая уже «Панацела» и компания «Онкотартис». Мы рассчитываем, что первые из этих препаратов достигнут стадии, на которой находится кураксин, примерно через два года. Тогда же можно ожидать начала испытаний на людях и первых препаратов против старения.
Получается, что у вас сегодня есть несколько групп препаратов, эффективных против рака?
— Коллеги мне задают вопрос: если один наш препарат, например тот, который разрабатывается компанией «Инкурон», сработает, зачем все остальное? Ну, во-первых, всегда хорошо иметь запасные пути. Во-вторых, наверняка найдутся формы опухолей, устойчивые к конкретному препарату. И в-третьих, разнообразие болезней, объединенных словом «рак», скорее всего, обеспечит применение многим новым препаратам и их комбинациям.
Этика против науки
Как удалось пройти бюрократические процедуры, связанные с клиническими испытаниями?
— Раз испытания идут, значит, как-то прошли. Главная проблема — избыточно забюрократизированная процедура получения формального разрешения на клинические испытания. Для примера: после того как Минздрав разрешил клинические испытания, на выдачу бумажки уходит 45 рабочих дней! И это — для препаратов от смертельной болезни.
Особенно страшно, когда чиновники решают «улучшить» ситуацию. Хорошо известно, что, когда два года назад был принят новый закон, регулирующий клинические испытания лекарств, весь процесс регистрации препаратов забуксовал года на полтора.
В России больше медицинской бюрократии, чем на Западе?
— В США в 70-е годы была создана служба FDA — Food and Drug Administration. Это государственная организация-арбитр, которая осуществляет надзор общества за безопасностью и этическими стандартами того, что людям дается в качестве лекарств. Задача FDA заключается в том, чтобы развитие фармакологии шло в соответствии с самыми высокими стандартами этики и безопасности. Выполнять эту задачу и при этом не быть тормозом развития медицины — невозможно. Потому что все новое, что ты даешь пациенту, — всегда риск. По мнению FDA, такой риск легче принять, если человек смертельно болен и предложить ему особо нечего. Поскольку многие формы рака на запущенных стадиях практически неизлечимы, получить разрешение на апробирование даже весьма рискованных препаратов на таких больных легче. Но если какие-никакие средства уже есть — где поставить этическую планку приемлемого риска? Каждый раз в таком решении много субъективного. И сдвигается эта планка все выше и выше по мере появления новых лекарств и удорожания человеческой жизни. Могу привести пример.
В 50-е годы А. Сэбин создал вакцину от полиомиелита. Эта вакцина — живой, но ослабленный вирус, капелька, которая дается на язык новорожденному. Она спасла миллионы детей во всем мире от смерти и уродств. Вакцина считалась исключительно безопасной: лишь 1 ребенок из 750 тысяч вакцинированных заболевал полиомиелитом от самой вакцинации. Но в современном мире, в котором уже нет эпидемий полиомиелита, даже такой риск становится неприемлемым: массовая вакцинация от полиомиелита прекращена.
Немалую роль в судьбе даже очень хороших лекарств играют и особенности западной юридической системы: ведь если человек в Америке заболел от нового лекарства, он может представить судебные иски такого масштаба, что и производителям лекарств, и FDA мало не покажется.
Получается, что чем дороже становится человеческая жизнь, тем труднее создавать лекарства, чтобы ее спасти…
— В Америке прохождение через FDA — многолетний, тяжелейший, безумно дорогостоящий процесс. Я это знаю не понаслышке: в FDA за последний год я был шесть раз, потому что наши препараты проходят через это агентство. Сидят перед тобой 10–20 человек, каждый из них отвечает за свою область экспертизы. Ты готовишь им материалы, часто состоящие из десятков тысяч (!) страниц текста и данных. Они разделяют его на части по специальностям, изучают. Каждый имеет ученую степень и является экспертом в своей области. И каждый старается придумать, где и в чем твой препарат может быть опасным для человека. И чем более инновационный препарат, тем больше он вызывает страхов, тем тяжелее он будет проходить через FDA.
Особенно сложно проходят сито отбора лекарства для профилактики болезней. Потому что профилактика по определению применяется к здоровым людям. Экспериментировать на них, подвергать их даже малейшему риску считается неприемлемым. Именно поэтому большинство крупных фармакологических компаний не хотят даже разговаривать на тему профилактики болезней. Потому что сделать на этом реалистическую бизнес-модель невозможно.
Если, к примеру, мы захотим испытать кураксин как средство для профилактики рака, то в Америке это будет сложно и небыстро.
А в России?
— Пока не знаю. Будем стараться найти лучшие решения без нарушения этических принципов.
Когда появятся на рынке ваши препараты?
— Плюнем три раза через левое плечо и будем надеяться, что в 2016 году первый кураксин выйдет на медицинский рынок.
Преступные наклонности
Андрей Владимирович, почему медицина, столь далеко продвинувшаяся в решении многих проблем, пока не может справиться с таким заболеванием, как рак?
— Бывает два типа болезней. Есть недуги, обусловленные тем, что в организме что-то сломалось или засорилось, например, сердечно-сосудистые заболевания. Что такое сердечнососудистая система? Это, в сущности, водопровод: трубы и насос. Трубы могут засориться, насос — сломаться. Значит, нужно поменять насос и прочистить трубы. И сердце будет продолжать работать.

Но есть болезни, вызванные альтернативными формами жизни. К ним относятся инфекции и рак. Рак — это наши собственные клетки, которые перестали вести себя адекватно. Онкозаболевание можно сравнить с социальными недугами, например, с преступностью. Мы не можем победить рак потому же, почему не можем искоренить преступность. Злоумышленники внешне мало чем отличаются от обычных людей, они похожи на нас, к тому же виртуозно умеют уклоняться от наказания. Ровно поэтому же мы не можем избавиться от тараканов, насекомых-вредителей, крыс и мышей. Так вот рак — живой, его появление в организме вызвано не поломкой какого-то органа, а возникновением альтернативной формы жизни, которая борется за существование, правдами и неправдами избегая уничтожения, изменяясь и приспосабливаясь к лечению.
Есть ли какие-то предпосылки к тому, что будет найдено средство от этой страшной болезни?
— Перспективы победы над раком есть, и они вполне реальные. Последние сорок лет наука училась понимать рак. Болезнь перестала быть чем-то мистическим, и это очень важно. Сегодня мы уже знаем, что она связана с серией генетических или эпигенетических изменений, приобретенных редкими соматическими клетками нашего организма, которые в совокупности меняют клеточный фенотип (т.е. совокупность признаков), делают клетку все более и более эгоистичной и все менее и менее послушной законам клеточного социума.
Поясните, пожалуйста, что такое эпигенетические изменения?
— Все клетки нашего организма рождаются одинаковыми, с одним и тем же набором ДНК. Такая ситуация сохраняется и после приобретения клетками «профессий». Например, клетка-нейрон, которая живет в мозге, имеет ту же совокупность генов, что и клетки крови или кожи. Отличие клеток в том, какая часть генома доступна им для прочтения и работы. Можно сравнить ядро нашей клетки, где хранится ДНК, с библиотекой, где на полках хранится все культурное наследие человечества. Но вам доступны далеко не все книги в этой библиотеке. Какие-то стеллажи, а то и целые шкафы получают статус спецхрана. Огромные части ДНК в любой «профессиональной» клетке тоже закрыты для чтения. Поэтому клетка-нейрон не умеет синтезировать белки кожи, и наоборот, клетка кожи не производит белков нервной ткани. Получается, что хотя клетки формально одинаковы с точки зрения хранимой информации, то есть генетически идентичны, доступ к разным частям генома у них неодинаков, а значит, отличаются и свойства. Мы говорим, что они разные эпигенетически.
Но если кто-то проникнет без разрешения в спецхран и получит доступ к секретной информации, это и называется эпигенетическое событие — прочесть запретное, стать диссидентом. То есть вы приобретаете не мутацию, а возможность доступа к тем частям генома, которые в норме должны быть закрыты.
Фактически есть два механизма, с помощью которых у клетки меняется работа генома. Можно приобрести мутации, которые физически изменяют «текст» (структуру ДНК), а можно, не приобретая мутаций, изменить доступ к разным генам. Это и называется эпигенетическое изменение. И то и другое может в равной степени внести свой «вклад» в создание ракового фенотипа.
Наш организм есть социум примерно из триллиона клеток. Это профессионалы, выполняющие определенную функцию и собранные в органы и ткани. Между ними есть «договоренность» не пересекать границы своих органов. Раковые клетки нарушают это обязательство, размножаясь и создавая многочисленное потомство (рак — заболевание, которое связано с пробуждением и постепенным усилением в клетках эгоистических тенденций). В результате они образуют новый тип жизни, которая паразитически развивается в организме человека. Раковые клетки строят огромные колонии из себе подобных (первичная опухоль), а потом распространяются по всему организму, образуя поселения в неположенных местах (метастазы). Этот процесс называется прогрессией или эскалацией плохого. И снова напрашивается сравнение с преступностью. Допустим, что некая преступная группа возникает где-нибудь в Урюпинске и сначала она собирает дань только со своего города. Но с течением времени банда расширяется и начинает распространять свое влияние на всю область, затем на регион, страну, потом группировка становится международной. Так же и онкозаболевание. Рак печени сначала живет в печени. И даже когда возникают метастазы, они вначале растут как новые узлы в том же органе. Но потом появляется клетка, которая может жить и размножаться в позвоночнике или в легких. Возникает новый узел. По мере того как этот узел растет, клеткам внутри него становится душно, им не хватает кислорода. Начинается борьба за существование, естественный отбор. Только те клетки смогут выжить, которые привлекут к себе кровеносный сосуд, несущий пищу и кислород.
Казалось бы, рак должен уничтожаться иммунной системой, умеющей распознавать клетки, приобретшие новые свойства. К сожалению, больные клетки находят способы оставаться невидимыми для иммунной системы, причем каждая опухоль каждый раз «придумывает» новый способ защиты.
Рак — очень сложный фенотип, как и фенотип преступника. Нельзя стать убийцей, изменив в себе лишь одно свойство, одну черту характера. Должно поменяться мировоззрение, все жизненные ценности. Так же и в раковой клетке. Что характерно для всех людей, которые вступили на путь преступления? Их всех без исключения, таких непохожих, роднит одно — отсутствие внутреннего морального закона, оберегающего от неэтичных асоциальных поступков. Потеря совести. У каждой нормальной клетки есть механизм, который различает, хорошая она или плохая. Плохая клетка — эта, которая приобрела либо мутации, либо с ней произошли эпигенетические изменения, о которых я говорил. Тогда включается механизм, который измененную клетку наказывает. Либо ей навсегда запрещается делиться (в этом случае клетка становится сенесцентной, то есть преждевременно стареет), либо такая клетка включает программу самоубийства — апоптоз. А когда этот механизм сломан, плохие клетки вступают в борьбу за выживание. Возникает рак.
Два порока современной науки
Что мешает восстановить механизм саморегуляции клеток?
— Рак — это живой организм, который активно избегает лечения, создавая новые устойчивые к лекарствам формы. К тому же, повторюсь, не бывает двух одинаковых раков. Каждое онкологическое заболевание абсолютно уникально. Поэтому невозможно предсказать, какая комбинация свойств будет у этой версии рака, стало быть, сложно выработать тактику индивидуального лечения. Впрочем, сегодня большие надежды связываются с personalized medicine, которая будет предлагать индивидуальное лечение каждого конкретного случая.
Вообще, способы, которыми сейчас лечат рак, направлены на то, чтобы не избавиться от него, а превратить его в хроническую контролируемую болезнь. Когда мы говорим о cancer survivors (переживших рак), мы имеем в виду людей, которые не исцелились совсем, а пройдя курс лечения (или несколько), продолжают жить с этим заболеванием и, если повезет, проживут еще долго. Например, моя мама. Тридцать два года назад у нее был диагностирован рак молочной железы. Затем были сложные и тяжелые периоды лечения, на фоне которого появился новый первичный рак груди, который дал метастазы в легкие. Ситуация казалась безнадежной. Но тактика российских врачей (вот уже 25 лет лечением руководит профессор М. Личиницер из Онкологического центра им. Н.Н. Блохина) оказалась удачной.
Сегодня большие надежды возлагаются на таргетную терапию…
— Ученые, как дети, склонны мечтать. Очень хочется объявить, что найдены все ахиллесовы пяты опухолевой клетки (т.е. мишени), что все готово к выпуску лекарства против найденных мишеней, будем диагностировать их и бить по ним. Последние 10 лет все новое, что разрабатывается в качестве препаратов против рака, — это препараты таргетной терапии. Излечили ли мы хоть один рак таргетной терапией радикально? Нет. Но стало ли возможно продлить жизнь больного? Да — до тех пор, пока в недрах погибающей опухоли не возникнет очередного мутантного варианта, устойчивого к лекарству. К сожалению, в большинстве случаев речь идет всего лишь о нескольких месяцах продления жизни. Но чтобы такие лекарства создать, требуются миллиарды долларов. Поэтому и продают их за непомерные деньги.
Тупик?
— Пока нет ни одного разрешенного к применению препарата, который бы позволил вылечить, в конце концов, эту болезнь. Но хорошим примером может быть борьба со СПИДом. Медицина эту относительно простую болезнь хоть и не до конца победила, но можно утверждать, что в цивилизованных странах СПИД под контролем. Против него эффективно работает коктейль лекарств, каждое из которых бьет по своей мишени. Мутация, которая позволяет вирусу уйти от одного таргетного препарата, возникает в одной вирусной частице на миллион. А вот чтобы уйти от двух таргетных ≪стрел≫, бьющих по двум мишеням, необходима комбинация из двух мутаций. Для этого нужно уже триллион вирусных частиц. А уж если коктейль состоит из трех таргетных лекарств, то чтобы уйти от него, должно быть такое количество вирусных частиц, какое вообще нереально. Вот почему эти коктейли дают такой хороший терапевтический эффект. Но раковая клетка — не вирус, а более изощренный механизм. В ней может быть столько комбинаций разных мишеней, и они так часто меняются, что задача диагностики исключительно сложна.
В прессе много пишут о кураксинах (от английского cure — «излечивать»), нового класса препаратов. Расскажите, как были открыты эти молекулы?
— Предшествующие знания в онкологии не могли помочь создать молекулу, которая сразу била бы по нескольким мишеням. И приди я с такой задачей в любой грантовый комитет, у меня не было бы никаких шансов получить финансирование. Там посчитали бы, что это сверхамбициозный и ничем не обоснованный проект. Подобным подходам грантовые комитеты выносят обвинительный вердикт — fi shing expedition (рыбалка). Грантовые заявки все больше напоминают бизнес-план, когда от ученого требуют надежный результат и конкретные сроки. Фактически современное финансирование науки поддерживает инженерные проекты дальнейшего изучения известного, а не проекты, направленные на открытие неизвестного. Слишком рискованные, креативные проекты не финансируются. А значит, рассчитывать можно только на людей типа Михаила Могутова, не боящихся, вопреки господствующим мнениям, поверить в идею и рискнуть своими деньгами. Особенность биологии как науки состоит в том, что в ней ученый-экспериментатор не только не понимает систему до конца, но и использует это недопонимание для того, чтобы система сама ему помогла. Если идея на первый взгляд кажется малообоснованной, сумасшедшей, не стоит с ходу ее отметать, потому что сегодняшнее знание несовершенно.
Возьмем раковые клетки, которые растут в культуре ткани. Выберем такие, в которых есть две ахиллесовы пяты — две мишени. И пусть ничто в научной литературе не указывает на то, что эти мишени могут быть хоть как-то связаны, мы начинаем перебирать сотни тысяч вариантов химических соединений в поисках того, который поразит обе мишени одновременно. И оказывается, такие соединения есть! Располагая такими соединениями, можно понять, как же они работают и как две мишени все-таки связаны друг с другом. И мы открываем новый механизм! Поиск и расшифровку механизма действия кураксинов вела группа биологов, химиков и фармакологов под руководством профессора Катерины Гуровой, которая сейчас заведует лабораторией в Отделе биологии клеточного стресса Онкологического института в Баффало. Дальнейшим развитием и внедрением кураксинов в клиническую практику занимается созданная нами совместно с «Биопроцессом» биотехнологическая компания «Инкурон».
Обмануть болезнь
Есть ли какие-то еще способы победить рак?
— Я рассказал про первый способ. Бить одновременно по нескольким мишеням, как это делают наши кураксины.
Второй — выбрать универсальную мишень, которая есть в каждом без исключения случае рака, и бить по ней.
Есть такой белок MYC. Он закодирован в нашей ДНК и абсолютно необходим для пролиферации, т.е. деления, всех клеток. MYC называют онко-белком, потому что его перепроизводство в клетке ведет к опухолевой трансформации. Хотя MYC был открыт в самом начале 80-х годов, мы по-прежнему не понимаем, как он работает. Однако на основании блестящих генетических исследований лаборатории Жерарда Эванса (Gerard Evans) мы уверены, что если будет лекарство, которое блокирует MYC, то оно остановит развитие любого рака и при этом не убьет организм, хотя и заморозит процессы клеточного деления. Да, во время лечения станут тоньше стенки кишечника, кожа, остановится рост волос, упадет иммунитет. Но это обратимые изменения. А вот для большинства раковых клеток подавление MYC будет смертельным: они не могут выдержать долго без пролиферации.
Но даже таким образом мы рак полностью не вылечим. Ведь придется на время отменять лекарство, чтобы подрастить кишечник, кожу, восстановить другие ткани. Есть вероятность, что рак при этом снова пойдет в рост. Но его можно будет все время, всю жизнь держать в узде новыми курсами терапии без особого риска получить устойчивый к лечению рак: похоже, что потеря онко-белка MYC для делящейся клетки невосполнима. Это будет очень интересный препарат, который превратит рак в хроническое контролируемое заболевание. Называется этот проект АНТИМИКОН, его ведет биотехнологическая компания «Панацела Лэбз», возглавляет профессор Михаил Никифоров, другой мой коллега по отделу биологии клеточного стресса здесь, в Баффало. Финансирует проект корпорация «Роснано».
Любопытно, что MYC как мишень не оказался в фокусе больших фармацевтических компаний…
Они страдают тем же пороком, что и грантовые комитеты: как правило, не поддерживают проектов до тех пор, пока не станет понятен механизм действия лекарства.
Теперь я перехожу к самому главному. Рак возникает из комбинации генетических и/или эпигенетических изменений. Комбинация — ключевое слово. Не бывает одного генетического изменения, которого бы хватило, чтобы превратить нормальную клетку в раковую. Для клетки мышей достаточно трех событий. Для клетки человека — 4–6. Это означает, что в каждый конкретный момент времени каждый из нас, даже если мы считаемся здоровыми, носит в себе миллионы клеток, которые уже получили одну-две-три мутации. И они-то и составляют популяцию высокого риска, из которой потом, после приобретения последних недостающих изменений, и возникает рак. Если мы научимся такие клетки распознавать и время от времени уничтожать, то не из чего будет раку возникнуть.
Помня, что кураксины направлены против нескольких мишеней сразу, причем таких, которые появляются у опухолевой клетки на ранних стадиях, возникла идея использовать их для «очистки» организма от клеток высокого риска. То есть давать кураксины превентивно. Это была довольно смелая идея, и она тоже шла вразрез с общепринятой практикой применения противораковых препаратов. Вот почему. Рак сегодня лечат радиацией и химиотерапией, которые хоть и опасны для здоровых клеток, но для раковых — опаснее. В дурном сне не приснится облучать здорового человека или кормить его каким-нибудь доксорубицином или 5-фторурацилом (это — стандартные широко применяемые противораковые препараты, которые повреждают ДНК) для того, чтобы у него потом не было рака. Мы их используем только потому, что рак опаснее, чем такая терапия: мы пытаемся купить человеку несколько лет жизни, хотя и понимаем, что в случае успеха заплатим риском новых заболеваний в будущем.
Так вот кураксины не провоцируют генетических изменений клетки. А значит, есть смысл их попробовать в качестве профилактических агентов.
Мы поставили две серии долгосрочных экспериментов, взяли две модели рака: в одной рак был спровоцирован «плохой» генетикой, а в другой — химическим канцерогеном. Один опыт был поставлен в Баффало, другой — в Москве, в лаборатории профессора Марианны Якубовской в Онкологическом центре им. Н.Н. Блохина. В первом случае были взяты мыши, у которых онкоген her2 был искусственно включен в клетки молочной железы. У самок таких мышей в течение первого года жизни — а мыши живут два года — со 100% гарантией возникает рак молочной железы, и они погибают. Для второй модели были взяты здоровые мыши, но их покормили диметилгидразином. Это — компонент ракетного топлива, мощный канцероген. Подавляющее большинство однажды обработанных им мышей развивают рак одного или нескольких типов.
И генетически предрасположенные, и отравленные канцерогеном мыши, начиная с трехмесячного возраста и до самой смерти, пили воду с растворенным в ней кураксином. В момент, когда от рака молочной железы умерла последняя мышь в контрольной группе, получавшей обычную воду, большинство мышей в группе, которая получала воду с кураксином, еще не имели опухолей, и половина из них умерли от старости, а не от рака. А те опухоли, которые возникли, были менее агрессивны, чем аналогичные опухоли в контрольной группе. То же самое можно было наблюдать и в случае отравленных канцерогеном мышей: в этой модели большинство раков задержалось в развитии, и частота их уменьшилась.
То есть возможна профилактика рака?
— Профилактика преступности клеток. Если создать препараты, которые будут узнавать клетки, получившие только первые изменения, то, проводя периодические курсы «очистительной» терапии, можно снять проблему.
Рак и старость — братья-близнецы
Уровень заболеваемости раком резко возрастает к старости. Онкология и возраст действительно взаимосвязаны?
— Что такое старение? Это возникновение системного, мягкого, хронического воспаления всего организма, скорее всего, связанное с накоплением сенесцентных клеток, которые и являются источником воспаления. В этом смысле старение и рак — близнецы и братья. Одно есть следствие другого. 70% мужчин, достигших 70-летнего возраста, имеют рак простаты. А 90-летние — 90%. Поразительно, что на ранних стадиях развития таких раков даже одно снятие воспаления приводит к тому, что болезнь уходит. Так, например, может исчезнуть рак желудка ранней стадии, когда удается избавиться от Helicobacter pylory с помощью антибиотиков.
Есть, таким образом, два способа профилактики онкопроцесса. Первый способ — отличать те клетки, которые приобрели признаки «преступности» и уничтожать их, тем самым отнимая у рака саму возможность возникнуть. И второй — бороться с системными изменениями, связанными со старением, уничтожая лекарственными методами клетки — источники старческого воспаления. Эту задачу решает наша компания «Тартисстарение», также финансируемая «Биопроцессом». То есть производить периодическое омолаживание организма, решая при этом массу проблем.
Если раньше накопление сенесцентных клеток как причина старения было одной из многих теорий, то сейчас она начинает доминировать в геронтологии…
— Молекулы — прототипы будущих лекарств у нас уже есть. Мы доказали, что старческие клетки можно уничтожать, не трогая молодые, а значит, сама болезнь является поддающейся лечению. Это отправная точка. У нас есть препараты, которые отличают старую клетку от молодой, и в недалеком будущем можно ожидать их проверки на животных.
То, что наша программа борьбы со старением состоялась, — это в большой степени заслуга Михаила Могутова. Если бы не его смелость и доверие, то на момент создания этой компании получить деньги на такие исследования на биотехнологическом рынке было бы невозможно.
А похоже, риск был оправдан.
Революционные препараты: тише, идут испытания
Почему клинические испытания своих препаратов вы проводите в России, а не в Америке?
— Для исследователя самое главное — скорость. Кстати, с этим обстоятельством отчасти связана массовая миграция ученых в Америку далеко не только из России, а и из более благополучных стран: в этой стране безусловный приоритет скорости во всем. Кроме процесса развития лекарств, быстрота которого в США сдерживается жесточайшими требованиями безопасности и надежности.
Вот и получается, что довести препарат до испытаний в России быстрее, а значит, быстрее можно получить ценнейшие сведения о том, как он себя поведет на больных. И хотя полученных по российским правилам сведений будет недостаточно, чтобы обеспечить одобрение лекарства в Америке, такие сведения позволят оптимально спланировать и эффективнее провести испытания по американским стандартам. В конечном итоге выиграют все.
На какой стадии сейчас находятся испытания препаратов?
— Первый кураксин (CBLC0137) проходит клинические испытания в России. Они ведутся в нескольких медицинских центрах, и их координирует профессор С. Тюляндин из Онкоцентра им. Блохина.
Первая фаза — это определение границ применимости препарата, характеристика его поведения в человеческом организме и переносимости. И хотя всегда есть надежда, что уже в первой фазе мы сможем помочь больному, все же главная задача — доказать, что препарат не вреден, и дойти до максимальных возможных доз.
Задача второй фазы — показать позитивный эффект на больных с определенным типом рака. Естественно, начать вторые фазы испытаний будет возможно, только когда мы убедимся, что в первой фазе дошли до таких доз кураксина, от которых можно ждать эффекта. На этой стадии мы начнем также испытывать предварительно опробованные в лаборатории комбинации кураксина с традиционными препаратами.
Как я уже говорил, сходная программа испытаний начнется в Америке, где все для этого готово. В России мы используем оральную форму кураксина, в Америке — инъекционную.
Целую серию новых противораковых препаратов, основанных на других, нежели кураксины, принципах убийства опухолевой клетки, разрабатывают две другие российско-американские компании — упомянутая уже «Панацела» и компания «Онкотартис». Мы рассчитываем, что первые из этих препаратов достигнут стадии, на которой находится кураксин, примерно через два года. Тогда же можно ожидать начала испытаний на людях и первых препаратов против старения.
Получается, что у вас сегодня есть несколько групп препаратов, эффективных против рака?
— Коллеги мне задают вопрос: если один наш препарат, например тот, который разрабатывается компанией «Инкурон», сработает, зачем все остальное? Ну, во-первых, всегда хорошо иметь запасные пути. Во-вторых, наверняка найдутся формы опухолей, устойчивые к конкретному препарату. И в-третьих, разнообразие болезней, объединенных словом «рак», скорее всего, обеспечит применение многим новым препаратам и их комбинациям.
Этика против науки
Как удалось пройти бюрократические процедуры, связанные с клиническими испытаниями?
— Раз испытания идут, значит, как-то прошли. Главная проблема — избыточно забюрократизированная процедура получения формального разрешения на клинические испытания. Для примера: после того как Минздрав разрешил клинические испытания, на выдачу бумажки уходит 45 рабочих дней! И это — для препаратов от смертельной болезни.
Особенно страшно, когда чиновники решают «улучшить» ситуацию. Хорошо известно, что, когда два года назад был принят новый закон, регулирующий клинические испытания лекарств, весь процесс регистрации препаратов забуксовал года на полтора.
В России больше медицинской бюрократии, чем на Западе?
— В США в 70-е годы была создана служба FDA — Food and Drug Administration. Это государственная организация-арбитр, которая осуществляет надзор общества за безопасностью и этическими стандартами того, что людям дается в качестве лекарств. Задача FDA заключается в том, чтобы развитие фармакологии шло в соответствии с самыми высокими стандартами этики и безопасности. Выполнять эту задачу и при этом не быть тормозом развития медицины — невозможно. Потому что все новое, что ты даешь пациенту, — всегда риск. По мнению FDA, такой риск легче принять, если человек смертельно болен и предложить ему особо нечего. Поскольку многие формы рака на запущенных стадиях практически неизлечимы, получить разрешение на апробирование даже весьма рискованных препаратов на таких больных легче. Но если какие-никакие средства уже есть — где поставить этическую планку приемлемого риска? Каждый раз в таком решении много субъективного. И сдвигается эта планка все выше и выше по мере появления новых лекарств и удорожания человеческой жизни. Могу привести пример.
В 50-е годы А. Сэбин создал вакцину от полиомиелита. Эта вакцина — живой, но ослабленный вирус, капелька, которая дается на язык новорожденному. Она спасла миллионы детей во всем мире от смерти и уродств. Вакцина считалась исключительно безопасной: лишь 1 ребенок из 750 тысяч вакцинированных заболевал полиомиелитом от самой вакцинации. Но в современном мире, в котором уже нет эпидемий полиомиелита, даже такой риск становится неприемлемым: массовая вакцинация от полиомиелита прекращена.
Немалую роль в судьбе даже очень хороших лекарств играют и особенности западной юридической системы: ведь если человек в Америке заболел от нового лекарства, он может представить судебные иски такого масштаба, что и производителям лекарств, и FDA мало не покажется.
Получается, что чем дороже становится человеческая жизнь, тем труднее создавать лекарства, чтобы ее спасти…
— В Америке прохождение через FDA — многолетний, тяжелейший, безумно дорогостоящий процесс. Я это знаю не понаслышке: в FDA за последний год я был шесть раз, потому что наши препараты проходят через это агентство. Сидят перед тобой 10–20 человек, каждый из них отвечает за свою область экспертизы. Ты готовишь им материалы, часто состоящие из десятков тысяч (!) страниц текста и данных. Они разделяют его на части по специальностям, изучают. Каждый имеет ученую степень и является экспертом в своей области. И каждый старается придумать, где и в чем твой препарат может быть опасным для человека. И чем более инновационный препарат, тем больше он вызывает страхов, тем тяжелее он будет проходить через FDA.
Особенно сложно проходят сито отбора лекарства для профилактики болезней. Потому что профилактика по определению применяется к здоровым людям. Экспериментировать на них, подвергать их даже малейшему риску считается неприемлемым. Именно поэтому большинство крупных фармакологических компаний не хотят даже разговаривать на тему профилактики болезней. Потому что сделать на этом реалистическую бизнес-модель невозможно.
Если, к примеру, мы захотим испытать кураксин как средство для профилактики рака, то в Америке это будет сложно и небыстро.
А в России?
— Пока не знаю. Будем стараться найти лучшие решения без нарушения этических принципов.
Когда появятся на рынке ваши препараты?
— Плюнем три раза через левое плечо и будем надеяться, что в 2016 году первый кураксин выйдет на медицинский рынок.
Портал БАШНЯ. Копирование, Перепечатка возможна при указании активной ссылки на данную страницу.
Основную прибыль фармацевтам приносят 200 выдуманных недугов
10 советов тем, кто учит английский, от человека, владеющего 16 языками