440
Чому діти та онуки Зоряних батьків мають діабет
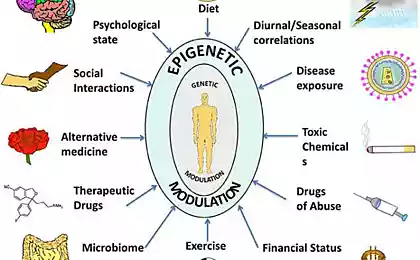
Негативні наслідки стресу, що передається від батьків до дітей, можуть бути пояснені роботою епігенетичних механізмів – але передача того ж ефекту для онуків епігенетичних гіпотезів більше не пояснюється.

Вплив стресу може передаватися через кілька поколінь, відповідно до ряду досліджень. Одним з найвідоміших прикладів є підвищення схильності до діабету і ожиріння дітей і онуків голландських жінок, які пережили знаменитий голод взимку 1944 року. З іншого боку, тваринні експерименти показали, що якщо вагітні жінки дають деякий вид токсину або просто лякати чоловіків батьками, то хімічний або психологічний стрес буде впливати не тільки на самих батьків, але і їх дітей - фізіологічні або поведінкові риси, які виник внаслідок стресу будуть спадковими. Однак тут не відбуваються мутації, генетичний код, що міститься в ДНК, не змінюється. Це означає, що епігенетичні механізми вступають у гру, які, не змінюючи послідовність нуклеотидів у ДНК, змінюють їх так, щоб гени змінюють свою активність.
Але саме те, що відбувається модифікація ДНК і як вони передається від покоління до покоління, біологи ще не повністю розуміють. Нові таємниці кинулися тут за роботою Енн Фергусон-Сміта та Марії-Елізабета Патті. Разом з колегами з Кембриджського, Гарвардського та університету Базель, вони застосували наступний експеримент: обмеження їжі вагітних мишей для виявлення епігенетичних змін у їх потомстві, що відбувався внаслідок голоду.
Є кілька різних видів епігенетичних механізмів, і один з них є вкладенням метилових груп до нуклеотидів у ДНК. Метилація змінює активність генів, і в цьому випадку він був зосередженням дослідників. При зрілих статевих клітинах, такі модифікації повністю зникають; можна сказати, що ДНК сперматозоїдів і яєць втрачає епігенетичну пам'ять. Але цей процес не 100%, деякі метилові групи на ДНК все ще залишаються. У експерименті мишей зрізали калорій в останній тиждень вагітності, так само, як і пригнічення ембріону сперматозоїдів були очищені їх ДНК епігенетичних ознак. Попереднє дослідження показали, що це в таких умовах, що відштовхування першого та другого покоління зросла ймовірність цукрового діабету.
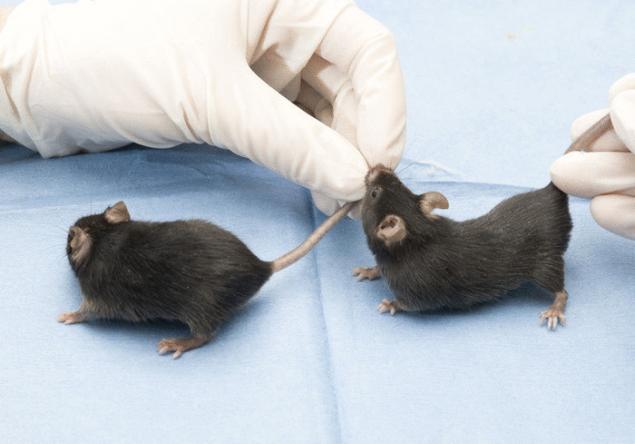
Виявилося, що сини голодуючих жіночих метильних груп на ерозії ДНК значно менше синів нормальних жінок. А відмінності були пов'язані з тими генами, які залучені до розвитку ожиріння і діабету, і які стали більш активними, ніж необхідно.
У другому генеруванні мишей гени в тканинах працювали з однаковими аномалією, тобто застібка онуків, уражених обміном, теж. Однак, як і автори роботи в Наука писати, не було відмінностей в епігенетичному патерні другого покоління, і більше не вдалося відрізнити нащадки крохмалюючого мишеня від нащадків тих, хто зазвичай з метилованої ДНК.
Знаходиться до того, що ми знаємо про епігенетичні механізми трансмісії напруги по генераціях, але піднімаємо багато питань. З’являється, що ДНК-метилація пояснюється кращою лише половиною ефекту – що ми бачимо в першому генеруванні. У онуках присутні епігенетичні відмінності, викликані голодом, але зміни активності гена. Епігенетичні механізми все ще можуть працювати тут, але їхні секрети ще повинні бути неоцінені.
Проте деякі скептики сумніваються в доцільності таких досліджень. Тварини, які використовуються в експериментах, таких як це завжди генетично нерозпушуються один від одного, тобто вони однакові чистої лінії. У той же час важко уявити таку ситуацію в природі – гени батьків завжди будуть різними. Патерн епігенетичний метил залежить від гена, на який він наділюється, тому при змішування різних геномів батьків, ембріон може мати комбінацію, схильну до поганих епігенетичних модифікацій. У цьому випадку, очевидно, метаболічні розлади будуть викликані не так багато тим, що мама під час вагітності зірвала, але за особливостями генетичного поєднання у дитини.
Джерело: nkj.ru

Вплив стресу може передаватися через кілька поколінь, відповідно до ряду досліджень. Одним з найвідоміших прикладів є підвищення схильності до діабету і ожиріння дітей і онуків голландських жінок, які пережили знаменитий голод взимку 1944 року. З іншого боку, тваринні експерименти показали, що якщо вагітні жінки дають деякий вид токсину або просто лякати чоловіків батьками, то хімічний або психологічний стрес буде впливати не тільки на самих батьків, але і їх дітей - фізіологічні або поведінкові риси, які виник внаслідок стресу будуть спадковими. Однак тут не відбуваються мутації, генетичний код, що міститься в ДНК, не змінюється. Це означає, що епігенетичні механізми вступають у гру, які, не змінюючи послідовність нуклеотидів у ДНК, змінюють їх так, щоб гени змінюють свою активність.

Але саме те, що відбувається модифікація ДНК і як вони передається від покоління до покоління, біологи ще не повністю розуміють. Нові таємниці кинулися тут за роботою Енн Фергусон-Сміта та Марії-Елізабета Патті. Разом з колегами з Кембриджського, Гарвардського та університету Базель, вони застосували наступний експеримент: обмеження їжі вагітних мишей для виявлення епігенетичних змін у їх потомстві, що відбувався внаслідок голоду.
Є кілька різних видів епігенетичних механізмів, і один з них є вкладенням метилових груп до нуклеотидів у ДНК. Метилація змінює активність генів, і в цьому випадку він був зосередженням дослідників. При зрілих статевих клітинах, такі модифікації повністю зникають; можна сказати, що ДНК сперматозоїдів і яєць втрачає епігенетичну пам'ять. Але цей процес не 100%, деякі метилові групи на ДНК все ще залишаються. У експерименті мишей зрізали калорій в останній тиждень вагітності, так само, як і пригнічення ембріону сперматозоїдів були очищені їх ДНК епігенетичних ознак. Попереднє дослідження показали, що це в таких умовах, що відштовхування першого та другого покоління зросла ймовірність цукрового діабету.

Виявилося, що сини голодуючих жіночих метильних груп на ерозії ДНК значно менше синів нормальних жінок. А відмінності були пов'язані з тими генами, які залучені до розвитку ожиріння і діабету, і які стали більш активними, ніж необхідно.
У другому генеруванні мишей гени в тканинах працювали з однаковими аномалією, тобто застібка онуків, уражених обміном, теж. Однак, як і автори роботи в Наука писати, не було відмінностей в епігенетичному патерні другого покоління, і більше не вдалося відрізнити нащадки крохмалюючого мишеня від нащадків тих, хто зазвичай з метилованої ДНК.
Знаходиться до того, що ми знаємо про епігенетичні механізми трансмісії напруги по генераціях, але піднімаємо багато питань. З’являється, що ДНК-метилація пояснюється кращою лише половиною ефекту – що ми бачимо в першому генеруванні. У онуках присутні епігенетичні відмінності, викликані голодом, але зміни активності гена. Епігенетичні механізми все ще можуть працювати тут, але їхні секрети ще повинні бути неоцінені.
Проте деякі скептики сумніваються в доцільності таких досліджень. Тварини, які використовуються в експериментах, таких як це завжди генетично нерозпушуються один від одного, тобто вони однакові чистої лінії. У той же час важко уявити таку ситуацію в природі – гени батьків завжди будуть різними. Патерн епігенетичний метил залежить від гена, на який він наділюється, тому при змішування різних геномів батьків, ембріон може мати комбінацію, схильну до поганих епігенетичних модифікацій. У цьому випадку, очевидно, метаболічні розлади будуть викликані не так багато тим, що мама під час вагітності зірвала, але за особливостями генетичного поєднання у дитини.
Джерело: nkj.ru
Дочка Дад: навчальні роботи та помилки
26 чарівних гаджетів, які перетворять вашу кухню в реальний зоопарк