236
2017-05-07
Рэй Пит: фосфаты и старение
Избыток фосфатов может приводить к усилению воспалительных процессов, атрофии тканей, кальцификации кровеносных сосудов, раку, деменции и, вообще говоря, всех процессов старения. Эта тема становится весьма важной, поскольку расширяется применение фосфатов в качестве пищевых добавок.
Раньше считалось, что осложнения хронических заболеваний почек, связанные с повышенными значениями сывороточных фосфатов, — это явление, характерное сугубо для этих заболеваний. Но открытие гена клото (названного так в честь одного из героев греческой мифологии), регулирующего баланс фосфатов, привело к тому, что пришлось пересмотреть биологическую роль фосфатов.

В 19-м веке фосфор обычно называли пищей для мозга, а примерно с 1970 года его участие в клеточной регуляции встало в самый центр редукционистского мышления. АТФ, аденозинтрифосфат, рассматривают как источник энергии, который обеспечивает клеточное движение, а также снабжает энергией «насосы», поддерживающие состояние жизни, как источник циклического аденозинмонофосфата, являющегося общим активатором клеток, как донора фосфатной группы, которая активирует большое количество протеинов в «каскаде фосфорилирования».Когда в процессе старения ткани кальцифицируются, то ответственность за это возлагают на кальций (при этом игнорируется существование кристаллов фосфатат кальция в тканях) и поэтому рекомендуют диеты с низким содержанием кальция. С недавних пор именно кальций обвинили в том, что кальциевые добавки не дали ожидаемого эффекта, несмотря на то, что помимо кальция в этих добавках присутствуют и другие вещества, такие как цитрат, фосфат, оротат, аспартат и лактат.
У меня иной взгляд на «каскад фосфорилирования» и другие клеточные функции фосфата; он сформировался на основе моего понимания роли воды в клеточной физиологии. Популярная точка зрения состоит в том, что стимул изменяет форму белка-рецептора, что вынуждает его работать в качестве фермента, катализируя переход фосфатной группы с АТФ на другой белок, что в свою очередь изменяет его форму и переводит в активное состояние, в результате чего происходит передача фосфатных групп другим молекулам или отъем фосфатов у активных ферментов в цепных реакциях. Это стандартная биохимия, которую можно воспроизвести в пробирке.
Начиная примерно с 1970 года, когда уже было хорошо известно об участии фосфорилирования в активации ферментов при расщеплении гликогена, ученые стали замечать, что при сокращении мышечных клеток фермент гликогенфосфорилаза мгновенно активируется, а потом происходит фосфорилирование. В активации фермента участвует фосфорилирование, поэтому если что-то другое сначала активировало фермент (изменяя его форму), то присоединение фосфатной группы нельзя считать единственной причиной этого процесса в обычном редукционистском смысле. Фосфорилирование — это один из участников сложного причинного процесса. Я рассматривал это, как возможный пример действия, которое изменяющаяся водная структура оказывает на структуру белка и его функцию.
Как известно, если температура падает ниже определенного значения, ферменты внезапно теряют активность. Это происходит потому, что растворимые белки принимают такую форму, при которой их гидрофобные элементы, то есть жиро-подобные боковые цепи аминокислот, оказываются внутри, а части цепи с водорастворимыми аминокислотами располагаются снаружи, вступая в контакт с водой. «Влажность» воды, ее стремление отторгнуть маслянистые части молекулы белка снижается по мере падения температуры, поэтому у некоторых белков возникает нестабильное состояние, в котором относительно гидрофобная группа больше не отталкивается окружающей ее более холодной водой.
В живой клетке вода всегда находится на очень близком расстоянии от поверхности жиров или жироподобных белков. В серии экспериментов, которые были начаты еще в 1960-х годах, Уолтер Дрост-Хансен (Walter Drost-Hansen) показал, что вне зависимости от природы вещества вода вблизи поверхности структурно изменяется, становясь менее плотной, более объемной. Такая вода является более «липофильной», она адаптируется к присутствию жирового материала, как будто он является более холодным. Изменение свойств воды также влияет на растворимость ионов, при этом растворимость калия растет, а растворимость натрия, магния и кальция падает (Wiggins, 1973).
Когда мышца сокращается, она моментально уменьшается в объеме (Abbott and Baskin, 1962). Мышцы сокращаются и под действием чрезвычайно высокого давления. В обоих случаях производительный процесс сокращения связан с небольшим уменьшением объема. Во время сокращения мышцы или нерва выделяется тепло, что приводит к росту температуры. Во время отдыха, в процессе восстановления происходит поглощение тепла (Curtin and Woledge, 1974; Westphal, et al., 1999; Constable, et al. 1997). В случае нерва вслед за нагреванием, возникшим из-за возбуждения, температура нерва падает ниже исходной (Abbot, et al., 1965). Растягивание мышцы приводит к поглощению энергии (Constable, et al., 1997). Такие энергетические изменения, не сопровождаемые химическими изменениями, привели некоторых исследователей к заключению о том, что создание мышечного напряжение является процессом, «движимым энтропией» (Davis and Rodgers, 1995).
В 1858 году Кельвин писал о физике воды в мыльном пузыре: «… если пленку, такую как мыльный пузырь, растягивать, … то она остывает…». Это описание подходит и к поведению нервов и мышц, которые поглощают энергию в момент расслабления (или удлинения) и выделяют ее при возбуждении/сокращении.
Несколько групп экспериментаторов в течение последних 60 лет пытались разобраться, что происходит с недостающим теплом; некоторые высказывали предположение о наличии электрического или осмотического хранилища, а некоторые показали, что при растягивании происходит генерация АТФ, и поэтому отстаивали идею химического хранилища. Практически не исследовалась возможность физического хранения в форме структурных изменений водно-белково-жировой системы, взаимодействующей с такими химическими изменениями, как синтез АТФ.
В ранних исследованиях химии мышц и мышечного сокращения было обнаружено, что добавление АТФ в вязкий раствор мышечного экстракта снижало его вязкость, а потеря мышцей АТФ приводила к ее затвердеванию, как при окоченении. Если при этом значение рН не было слишком кислым, то при уменьшении содержания АТФ в мертвой мышце происходило ее сокращение. Сент-Дьерди обнаружил, что мышца, затвердевшая при окоченении, вновь становилась мягкой при добавлении АТФ.
Трупное окоченение — это крайняя степень усталости или истощения энергии. В ранних исследованиях было описано явление «контрактуры усталости», при котором мышца, доведенная до утраты способности реагировать на стимуляцию, максимально сокращена (это состояние также называли задержанной релаксацией). Ишемическая контрактура в отсутствие кровообращения возникает, когда исчерпан мышечный гликоген, и, таким образом, останавливается анаэробный механизм выработки АТФ (Kingsley, et al., 1991). Задержанная релаксация гипотиреоидной мышцы — это еще одна ситуация, в которой для расслабления очевидно требуется АТФ. (В рефлекс-тесте ахиллова сухожилия при гипотиреозе скорость релаксации замедлена, что можно заметить визуально). Задержка Т-волны на электрокардиограмме, диастолическая контрактура при сердечной недостаточности — это все тот же процесс задержанной релаксации. Вводя активный тиреоидный гормон, Т3, можно быстро вернуть к норме скорость релаксации, подобное благоприятное воздействие гормона используют при сердечной недостаточности (Pingitore, et al., 2008; Wang, et al., 2006; Pantos, et al., 2007; Galli, et al., 2008).
Большая часть магния в клетках связана с АТФ, комплекс магний-АТФ является фактором мышечного расслабления. Недостаток АТФ или магния приводит к мышечным спазмам. Когда происходит стимуляция клетки, АТФ выделяет не только неорганический фосфат, но и магний. При рН более 6.7 фосфат находится в дважды ионизированном состоянии, оказывая на воду такой же структурирующий эффект, как магний, кальций и натрий: молекулы воды мощно притягиваются к концентрированному электрическому заряду иона. Увеличение концентрации свободного фосфата и магния противостоит влиянию жировых и белковых поверхностей на структуру воды, приводит к снижению растворимости калия в воде, а также наращивает «липофобную» склонность воды минимизировать контакт с жирами и жиро-подобными участками на поверхности белков, вынуждая белки перестраиваться.
Наблюдения, касающиеся взаимодействий в мышцах и нервах воды, растворенных веществ и белков, предлагают четкий контекст для понимания процессов сокращения и проводимости, которого не найти в знакомых описаниях, базирующихся на понятиях клеточных мембран, насосов и перекрещенных мостов. Я думаю, что эти наблюдения также предлагают уникально полезный контекст для понимания возможных опасных последствий избыточного содержания фосфатов в организме.
Некоторые ученые (M. Thomson, J. Gunawardena, A. K. Manrai) показывают, что принцип действующих масс помогает упростить понимание сетей фосфориляции и дефосфориляции, которые участвуют в клеточной регуляции. Вне зависимости от фосфорилирования белков присутствие иона фосфата в клеточной воде меняет ионную селективность клетки, сдвигая баланс в сторону повышенного поглощения натрия и кальция, снижая калий и проявляя тенденцию к деполяризации и «активированию» клетки.
Примерно 99 % публикаций, в которых обсуждаются механизмы мышечного сокращения, не затрагивают вопрос о роли воды; воду игнорируют и при обсуждении энергопроизводства в митохондриях. Неспособность к митохондриальному производству энергии приводит к перекисному окислению липидов, активирует воспалительные процессы и может вызвать дезинтеграцию энергопроизводящей структуры. Повышенная концентрация фосфата снижает митохондриальное энергопроизводство (Duan and Karmazyn, 1989), вызывает перекисное окисление липидов (Kowaltowski, et al., 1996), запускает воспалительные процессы, усиливает процессы тканевой атрофии, фиброз и рак.
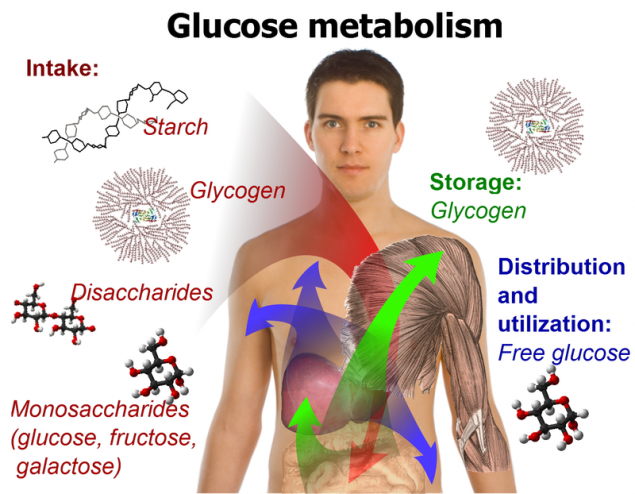
Уже двадцать лет, как известно, что метаболическая проблема, приводящая к потере кальция в костях, вызывает накопление кальция в мягких тканях, таких как кровеносные сосуды. До недавних пор считалось, что в процессах образования кристаллов фосфата кальция фосфаты играют пассивную роль, но были выявлены некоторые специфические «механистические» эффекты.
Например, повышенная концентрация фосфата приводит к росту воспалительного цитокина, остеопонтина (Fatherazi, et al., 2009), который известен своим свойством активировать в костях процесс декалицификации, а в артериях — участвовать в процессах кальцификации (Tousoulis, et al., 2012). Фосфаты повышают кальцификацию в почках (Bois and Selye, 1956), а остеопонтин, благодаря активированию воспалительных Т-клеток, принимает участие в развитии гломерулонефрита и воспалительных реакций кожи (Yu, et al., 1998).
Высокое содержание фосфатов в питании повышает концентрацию сывороточного остеопонтина, а также сывороточного фосфата и паратгормона, способствует образованию опухолей кожи (Camalier, et al., 2010). Помимо активации клеток и клеточных систем фосфаты (как и другие ионы с высоким отношением заряда к размеру, включая цитрат) способны активировать вирусы (Yamanaka, et al., 1995; Gouvea, et al., 2006). Ароматаза — фермент, синтезирующий эстроген —чувствительна к концентрации фосфата (Bellino and Holben, 1989).
Вообще говоря, повышенное содержание фосфата в питании усиливает активность важного регуляторного энзима, протеинкиназы B, который способствует росту органов. Диета с высоким содержанием фосфатов приводит к увеличению печени (Xu и другие, 2008) и легких (Jin и другие, 2007), поддерживает рост рака легких (Jin и другие, 2009).Но резкое ограничение фосфатов не будет правильным решением, поскольку их дефицит стимулирует фосфатный транспорт в клетках, увеличивая клеточное поглощение фосфатов и оказывая аналогичное действие, как и в условиях избытка фосфатов, то есть усиливая рост рака легких (Xu и другие, 2010). Оптимальное содержание фосфатов в диете и их доли в минеральном составе питания еще не определены.
Рост уровня фосфатов замедляет митохондриальное энергопроизводство, а снижение концентрации фосфатов в межклеточном пространстве приводит к росту респираторного индекса и эффективности образования АТФ. К такому же эффекту приводит «дефицит» полиненасыщенных жирных кислот (Nogueira и др., 2001) и употребление в пищу фруктозы (Green и др., 1993; Lu и др., 1994).
В 1938 году был поставлен эксперимент (Brown и др.) на человеке, который в течение шести месяцев получал рацион в 2500 килокалорий в день, состоявший из сиропа сахарозы, галлона молока (частично в виде зерненого творога), сока половины апельсина, а также некоторых витаминов и минералов в виде добавок.
Предполагалось, что этот эксперимент продемонстрирует незаменимость ненасыщенных жиров. Члены экспериментальной группы были весьма озадачены тем, что удивительным образом не наблюдали у испытуемого обычную усталость в конце рабочего дня. У него нормализовались повышенное кровяное давление и высокий уровень холестерина, а также совершенно прекратились мигрени, которыми он страдал всю жизнь. У него был отмечен рост дыхательного коэффициента (повысилась выработка углекислого газа) и скорость метаболизма в состоянии покоя. Я считаю, что самый интересный результат этого эксперимента — снижение содержания фосфата в крови испытуемого. У него дважды брали натощак анализ крови. Содержание сывороточного неогранического фосфора было на уровне 3,43 и 2,64 мг на 100 мл плазмы. По окончании исследования он вернулся к своей обычной диете, и уровень фосфора в его крови через полгода составлял уже 4,2 мг/100 мл. Можнопредположить, что снижение фосфатов в организме произошло как по причине дефицита «незаменимых» ненасыщенных жирных кислот, так и благодаря приему высоких доз сахарозы.
В 2000 году убежденные в опасных для здоровья свойствах фруктозы исследователи высказали предположение, что переход на рацион с дефицитом магния усилит вред, наносимый фруктозой. И одиннадцать человек приняли участие в полугодовом эксперименте, в течение которого получали питание с высоким содержанием кукурузного крахмала или сиропа, богатыми фруктозой. Им также давали другие типичные американские продукты либо с чрезвычайно низким содержанием магния, либо с некоторым его дефицитом. Вывод, к которому пришли исследователи, был четко прописан в названии их статьи и состоял в том, что описанная выше комбинация существенно ухудшает минеральный баланс в теле.
Однако, в контексте результатов других исследований, касающихся действия фруктозы на фосфаты, я не считаю упомянутые выше выводы верными. Даже в случае чрезвычайно бедной магнием диеты баланс и магния, и кальция был положительным, из чего можно сделать вывод о том, что в среднем организмы испытуемых потребляли очень мало кальция и магния, люди в возрасте от 22 до 40, по-видимому, не очень сильно растут.
При стабильном потреблении как кальция, так и магния, со значительным превышением усваиваемого уровня кальция, можно предположить, что минералы были усвоены в костях. Однако, в случае «высокофруктозной» диеты баланс фосфата был у них в незначительной степени отрицательным. Если бы сахар оказывал такое же действие, как и в эксперименте с Уильямом Брауном в 1938 году (и в экспериментах на животных), то некоторое снижение фосфата можно было бы объяснить уменьшением его количества в крови и других жидкостях, но по мере продолжения эксперимента это явление на каком-то этапе должно было отражать и изменения в составе костей. Когда в жидкостях тела содержится больше углекислого газа, то карбонат кальция может депонироваться в костях (Messier и др., 1979). Повышение уровня углекислого газа может приводить к длительному отрицательному балансу фосфата за счет роли, которую углекислый газ играет в биохимии костей при взаимодействии с кальцием и магнием.
Еще одно важное свойство углекислого газа — это его способность регулировать одновременно и кальций, и фосфат, повышая абсорбцию и удержание кальция (Canzanello и др., 1995) и усиливая выделение фосфата. Повышенные концентрации углекислоты (как растворенного газа) и бикарбоната (бикарбоната натрия) приводят к усиленному выделению фосфатов в моче, даже при отсутствии паратгормона. Если концентрация сывороточного бикарбоната находится ниже нормальных значений, то значительно возрастает реабсорбция фосфатов почками (Jehle и др., 1999). Ацетазоламид увеличивает удержание углекислого газа организмом, увеличивая выведение фосфатов с мочой. Большая доля кальция в крови — это положительно заряженный комплекс, состоящий из кальция и бикарбоната, его заряд равен единице (Hughes и др., 1984). Неумение обращаться с этой комплексной формой кальция приводит к ошибкам и при определении уровня кальция в крови, и при интерпретации его физиологического воздействия, включая его действие в межклеточном пространстве. Гипервентиляция может приводить скелетные мышцы в судорожное состояние, сужать ковеносные сосуды, возбуждать тромбоциты и другие клетки; удаление углекислого газа из крови снижает концентрацию угольной кислоты, изменяя состояние и функцию кальция. Гипервентиляция приводит к росту фосфата и паратгормона, снижает содержание кальция (Krapf и др., 1992).
Поскольку эстроген имеет тенденцию вызывать гипервентиляцию, а значит и снижение концентрации углекислого газа, его роль в метаболизме фосфата следует изучить более тщательно. В работах Han и др. (2002) и Xu и др. (2003) было показано, что эстроген увеличивает реабсорбцию фосфата почками, но эстроген также приводит и к росту кортизола, который снижает реабсорбцию, поэтому следует принимать во внимание влияние эстрогена на весь организм в целом.
Солюбилизирующее влияние на кальций со стороны бикарбоната в сочетании с его способностью к фосфатурии, возможно, является причиной расслабляющего действия углекислого газа на кровеносные сосуды и гладкую бронхиальную мускулатуру, а также лежит в основе механизма предотвращения кальцификации сосудов гормоном щитовидной железы (Sato и др., 2005, Tatar, 2009, Kim и др., 2012). Эластичность сосудов и сердца усиливается углекислым газом и, напротив, снижена при гипотиреозе, сердечной недостаточности и под действием фосфата.
Фруктоза не только снижает концентрацию фосфата в межклеточном пространстве, но также снижает его количество, усваиваемое в желудочно-кишечном тракте из пищи (Kirchner и др., 2008), а исследования Милна-Нильсена приводят к заключению, что она также повышает потерю фосфата через почки. «Антивозрастной» белок клото повышает способность почек выводить фосфат и, подобно фруктозе, он поддерживает энергопроизводство и термогенез (Mori и др., 2000).
Снижение фосфата в крови приводит к снижению паратгормона. Паратгормон, препятствуя реабсорбции фосфата почками, приводит к выработке серотонина тучными клетками (а серотонин увеличивает почечную реабсорбцию фосфата) и, возможно, обладает другими противовоспалительными свойствами. Например, делеция ПТГ гена компенсирует негативные последствия (ускоренная кальцификация и остеопороз) делеции гена клото, как выяснилось, путем предотвращения роста остеопонтина (Yuan и др., 2012).
Ниацинамид — это еще один нутриент, который снижает сывороточный фосфат (Cheng и др., 2008), подавляя его всасывание в кишечнике (Katai и др., 1989) и снижая его реабсорбцию в почках (Campbell и др., 1989). Возможно, способность ниацинамида снижать уровень свободных жирных кислот за счет ингибирования липолиза может играть роль и в процессе его влияния на фосфат (по аналогии с фосфатопонижающим действием при дефиците полиненасыщенных жирных кислот). Аспирин — еще одно противолиполитическое средство (de Zentella и др., 2002), которое стимулирует выработку энергии из сахара и снижает фосфат, возможно, способствуя удержанию магния (Yamada и Morohashi, 1986).
Диета, содержащая достаточное для ограничения активности паращитовидных желез количество кальция и низкое количество фосфата и полиненасыщенных жиров, в которой в качестве основного источника углеводов используется сахар, а не крахмал, а также с возможными добавками аспирина и ниацинамида, должна содействовать борьбе с дегенеративными процессами, связанными с высоким уровнем фосфата: слабостью, сердечной недостаточностью, дискоординацией движений, гипогонадизмом, бесплодием, кальцификацией сосудов, эмфиземой, раком, остеопорозом, атрофией кожи, скелетных мышц, кишечника, тимуса и селезенки (Ohnishi и Razzaque, 2010; Shiraki-Iida и др., 2000; Kuro-o и др., 1997; Osuka и Razzaque, 2012).Продукты, наиболее богатые фосфатом относительно содержания в них кальция, — это мюсли, бобовые, мясо и рыба. Фосфат добавляют во многие полуфабрикаты. Продукты с более высоким, безопасным соотношением кальция и фосфата — это листья капусты и свеклы, многие фрукты, молоко и сыр. Кофе, будучи хорошим источником магния, по-видимому, весьма эффективен в деле снижения фосфата за счет своего антагонизма к аденозину (Coulson и др., 1991).
Хотя повышенный фосфат обычно приводит к кальцификации сосудов (повышается их жесткость и, соответственно, растет систолическое давление крови), в случае, когда основная часть фосфата поступает с пищей из молока и сыра, эпидемиологичски его действие связывают со снижением кровяного давления (Takeda и др., 2012).
Токсичность фосфата приводит к некоторым весьма интересным выводам, касающимся стресса и старения и помогающим объяснить защитное действие углекислого газа, гормона щитовидной железы, сахара, ниацинамида и кальция. Его токсичность наводит на мысль о том, что следует внимательно изучить влияние других натуральных продуктов, используемых в качестве пищевых добавок. Например, избыток лимонной кислоты может активировать дремлющие раковые клетки (Havard и др., 2011) и приводить к их злокачественности (Blüml и др., 2011).Вообще говоря, исследования по установлению оптимальных соотношений между минералами, жирами, аминокислотами и другими веществами в продуктах питания, а также изучение их взаимодействия с натуральными токсинами, антинутриентами и веществами, разрушающими гормональную систему организма, едва начались. опубликовано
© Рей Пит
P.S. И помните, всего лишь изменяя свое потребление — мы вместе изменяем мир! ©
Источник: //ekiri22.blogspot.com/2015/02/blog-post.html
Раньше считалось, что осложнения хронических заболеваний почек, связанные с повышенными значениями сывороточных фосфатов, — это явление, характерное сугубо для этих заболеваний. Но открытие гена клото (названного так в честь одного из героев греческой мифологии), регулирующего баланс фосфатов, привело к тому, что пришлось пересмотреть биологическую роль фосфатов.

В 19-м веке фосфор обычно называли пищей для мозга, а примерно с 1970 года его участие в клеточной регуляции встало в самый центр редукционистского мышления. АТФ, аденозинтрифосфат, рассматривают как источник энергии, который обеспечивает клеточное движение, а также снабжает энергией «насосы», поддерживающие состояние жизни, как источник циклического аденозинмонофосфата, являющегося общим активатором клеток, как донора фосфатной группы, которая активирует большое количество протеинов в «каскаде фосфорилирования».Когда в процессе старения ткани кальцифицируются, то ответственность за это возлагают на кальций (при этом игнорируется существование кристаллов фосфатат кальция в тканях) и поэтому рекомендуют диеты с низким содержанием кальция. С недавних пор именно кальций обвинили в том, что кальциевые добавки не дали ожидаемого эффекта, несмотря на то, что помимо кальция в этих добавках присутствуют и другие вещества, такие как цитрат, фосфат, оротат, аспартат и лактат.
У меня иной взгляд на «каскад фосфорилирования» и другие клеточные функции фосфата; он сформировался на основе моего понимания роли воды в клеточной физиологии. Популярная точка зрения состоит в том, что стимул изменяет форму белка-рецептора, что вынуждает его работать в качестве фермента, катализируя переход фосфатной группы с АТФ на другой белок, что в свою очередь изменяет его форму и переводит в активное состояние, в результате чего происходит передача фосфатных групп другим молекулам или отъем фосфатов у активных ферментов в цепных реакциях. Это стандартная биохимия, которую можно воспроизвести в пробирке.
Начиная примерно с 1970 года, когда уже было хорошо известно об участии фосфорилирования в активации ферментов при расщеплении гликогена, ученые стали замечать, что при сокращении мышечных клеток фермент гликогенфосфорилаза мгновенно активируется, а потом происходит фосфорилирование. В активации фермента участвует фосфорилирование, поэтому если что-то другое сначала активировало фермент (изменяя его форму), то присоединение фосфатной группы нельзя считать единственной причиной этого процесса в обычном редукционистском смысле. Фосфорилирование — это один из участников сложного причинного процесса. Я рассматривал это, как возможный пример действия, которое изменяющаяся водная структура оказывает на структуру белка и его функцию.
Как известно, если температура падает ниже определенного значения, ферменты внезапно теряют активность. Это происходит потому, что растворимые белки принимают такую форму, при которой их гидрофобные элементы, то есть жиро-подобные боковые цепи аминокислот, оказываются внутри, а части цепи с водорастворимыми аминокислотами располагаются снаружи, вступая в контакт с водой. «Влажность» воды, ее стремление отторгнуть маслянистые части молекулы белка снижается по мере падения температуры, поэтому у некоторых белков возникает нестабильное состояние, в котором относительно гидрофобная группа больше не отталкивается окружающей ее более холодной водой.
В живой клетке вода всегда находится на очень близком расстоянии от поверхности жиров или жироподобных белков. В серии экспериментов, которые были начаты еще в 1960-х годах, Уолтер Дрост-Хансен (Walter Drost-Hansen) показал, что вне зависимости от природы вещества вода вблизи поверхности структурно изменяется, становясь менее плотной, более объемной. Такая вода является более «липофильной», она адаптируется к присутствию жирового материала, как будто он является более холодным. Изменение свойств воды также влияет на растворимость ионов, при этом растворимость калия растет, а растворимость натрия, магния и кальция падает (Wiggins, 1973).
Когда мышца сокращается, она моментально уменьшается в объеме (Abbott and Baskin, 1962). Мышцы сокращаются и под действием чрезвычайно высокого давления. В обоих случаях производительный процесс сокращения связан с небольшим уменьшением объема. Во время сокращения мышцы или нерва выделяется тепло, что приводит к росту температуры. Во время отдыха, в процессе восстановления происходит поглощение тепла (Curtin and Woledge, 1974; Westphal, et al., 1999; Constable, et al. 1997). В случае нерва вслед за нагреванием, возникшим из-за возбуждения, температура нерва падает ниже исходной (Abbot, et al., 1965). Растягивание мышцы приводит к поглощению энергии (Constable, et al., 1997). Такие энергетические изменения, не сопровождаемые химическими изменениями, привели некоторых исследователей к заключению о том, что создание мышечного напряжение является процессом, «движимым энтропией» (Davis and Rodgers, 1995).
В 1858 году Кельвин писал о физике воды в мыльном пузыре: «… если пленку, такую как мыльный пузырь, растягивать, … то она остывает…». Это описание подходит и к поведению нервов и мышц, которые поглощают энергию в момент расслабления (или удлинения) и выделяют ее при возбуждении/сокращении.
Несколько групп экспериментаторов в течение последних 60 лет пытались разобраться, что происходит с недостающим теплом; некоторые высказывали предположение о наличии электрического или осмотического хранилища, а некоторые показали, что при растягивании происходит генерация АТФ, и поэтому отстаивали идею химического хранилища. Практически не исследовалась возможность физического хранения в форме структурных изменений водно-белково-жировой системы, взаимодействующей с такими химическими изменениями, как синтез АТФ.
В ранних исследованиях химии мышц и мышечного сокращения было обнаружено, что добавление АТФ в вязкий раствор мышечного экстракта снижало его вязкость, а потеря мышцей АТФ приводила к ее затвердеванию, как при окоченении. Если при этом значение рН не было слишком кислым, то при уменьшении содержания АТФ в мертвой мышце происходило ее сокращение. Сент-Дьерди обнаружил, что мышца, затвердевшая при окоченении, вновь становилась мягкой при добавлении АТФ.
Трупное окоченение — это крайняя степень усталости или истощения энергии. В ранних исследованиях было описано явление «контрактуры усталости», при котором мышца, доведенная до утраты способности реагировать на стимуляцию, максимально сокращена (это состояние также называли задержанной релаксацией). Ишемическая контрактура в отсутствие кровообращения возникает, когда исчерпан мышечный гликоген, и, таким образом, останавливается анаэробный механизм выработки АТФ (Kingsley, et al., 1991). Задержанная релаксация гипотиреоидной мышцы — это еще одна ситуация, в которой для расслабления очевидно требуется АТФ. (В рефлекс-тесте ахиллова сухожилия при гипотиреозе скорость релаксации замедлена, что можно заметить визуально). Задержка Т-волны на электрокардиограмме, диастолическая контрактура при сердечной недостаточности — это все тот же процесс задержанной релаксации. Вводя активный тиреоидный гормон, Т3, можно быстро вернуть к норме скорость релаксации, подобное благоприятное воздействие гормона используют при сердечной недостаточности (Pingitore, et al., 2008; Wang, et al., 2006; Pantos, et al., 2007; Galli, et al., 2008).
Большая часть магния в клетках связана с АТФ, комплекс магний-АТФ является фактором мышечного расслабления. Недостаток АТФ или магния приводит к мышечным спазмам. Когда происходит стимуляция клетки, АТФ выделяет не только неорганический фосфат, но и магний. При рН более 6.7 фосфат находится в дважды ионизированном состоянии, оказывая на воду такой же структурирующий эффект, как магний, кальций и натрий: молекулы воды мощно притягиваются к концентрированному электрическому заряду иона. Увеличение концентрации свободного фосфата и магния противостоит влиянию жировых и белковых поверхностей на структуру воды, приводит к снижению растворимости калия в воде, а также наращивает «липофобную» склонность воды минимизировать контакт с жирами и жиро-подобными участками на поверхности белков, вынуждая белки перестраиваться.
Наблюдения, касающиеся взаимодействий в мышцах и нервах воды, растворенных веществ и белков, предлагают четкий контекст для понимания процессов сокращения и проводимости, которого не найти в знакомых описаниях, базирующихся на понятиях клеточных мембран, насосов и перекрещенных мостов. Я думаю, что эти наблюдения также предлагают уникально полезный контекст для понимания возможных опасных последствий избыточного содержания фосфатов в организме.
Некоторые ученые (M. Thomson, J. Gunawardena, A. K. Manrai) показывают, что принцип действующих масс помогает упростить понимание сетей фосфориляции и дефосфориляции, которые участвуют в клеточной регуляции. Вне зависимости от фосфорилирования белков присутствие иона фосфата в клеточной воде меняет ионную селективность клетки, сдвигая баланс в сторону повышенного поглощения натрия и кальция, снижая калий и проявляя тенденцию к деполяризации и «активированию» клетки.
Примерно 99 % публикаций, в которых обсуждаются механизмы мышечного сокращения, не затрагивают вопрос о роли воды; воду игнорируют и при обсуждении энергопроизводства в митохондриях. Неспособность к митохондриальному производству энергии приводит к перекисному окислению липидов, активирует воспалительные процессы и может вызвать дезинтеграцию энергопроизводящей структуры. Повышенная концентрация фосфата снижает митохондриальное энергопроизводство (Duan and Karmazyn, 1989), вызывает перекисное окисление липидов (Kowaltowski, et al., 1996), запускает воспалительные процессы, усиливает процессы тканевой атрофии, фиброз и рак.

Уже двадцать лет, как известно, что метаболическая проблема, приводящая к потере кальция в костях, вызывает накопление кальция в мягких тканях, таких как кровеносные сосуды. До недавних пор считалось, что в процессах образования кристаллов фосфата кальция фосфаты играют пассивную роль, но были выявлены некоторые специфические «механистические» эффекты.
Например, повышенная концентрация фосфата приводит к росту воспалительного цитокина, остеопонтина (Fatherazi, et al., 2009), который известен своим свойством активировать в костях процесс декалицификации, а в артериях — участвовать в процессах кальцификации (Tousoulis, et al., 2012). Фосфаты повышают кальцификацию в почках (Bois and Selye, 1956), а остеопонтин, благодаря активированию воспалительных Т-клеток, принимает участие в развитии гломерулонефрита и воспалительных реакций кожи (Yu, et al., 1998).
Высокое содержание фосфатов в питании повышает концентрацию сывороточного остеопонтина, а также сывороточного фосфата и паратгормона, способствует образованию опухолей кожи (Camalier, et al., 2010). Помимо активации клеток и клеточных систем фосфаты (как и другие ионы с высоким отношением заряда к размеру, включая цитрат) способны активировать вирусы (Yamanaka, et al., 1995; Gouvea, et al., 2006). Ароматаза — фермент, синтезирующий эстроген —чувствительна к концентрации фосфата (Bellino and Holben, 1989).
Вообще говоря, повышенное содержание фосфата в питании усиливает активность важного регуляторного энзима, протеинкиназы B, который способствует росту органов. Диета с высоким содержанием фосфатов приводит к увеличению печени (Xu и другие, 2008) и легких (Jin и другие, 2007), поддерживает рост рака легких (Jin и другие, 2009).Но резкое ограничение фосфатов не будет правильным решением, поскольку их дефицит стимулирует фосфатный транспорт в клетках, увеличивая клеточное поглощение фосфатов и оказывая аналогичное действие, как и в условиях избытка фосфатов, то есть усиливая рост рака легких (Xu и другие, 2010). Оптимальное содержание фосфатов в диете и их доли в минеральном составе питания еще не определены.
Рост уровня фосфатов замедляет митохондриальное энергопроизводство, а снижение концентрации фосфатов в межклеточном пространстве приводит к росту респираторного индекса и эффективности образования АТФ. К такому же эффекту приводит «дефицит» полиненасыщенных жирных кислот (Nogueira и др., 2001) и употребление в пищу фруктозы (Green и др., 1993; Lu и др., 1994).
В 1938 году был поставлен эксперимент (Brown и др.) на человеке, который в течение шести месяцев получал рацион в 2500 килокалорий в день, состоявший из сиропа сахарозы, галлона молока (частично в виде зерненого творога), сока половины апельсина, а также некоторых витаминов и минералов в виде добавок.
Предполагалось, что этот эксперимент продемонстрирует незаменимость ненасыщенных жиров. Члены экспериментальной группы были весьма озадачены тем, что удивительным образом не наблюдали у испытуемого обычную усталость в конце рабочего дня. У него нормализовались повышенное кровяное давление и высокий уровень холестерина, а также совершенно прекратились мигрени, которыми он страдал всю жизнь. У него был отмечен рост дыхательного коэффициента (повысилась выработка углекислого газа) и скорость метаболизма в состоянии покоя. Я считаю, что самый интересный результат этого эксперимента — снижение содержания фосфата в крови испытуемого. У него дважды брали натощак анализ крови. Содержание сывороточного неогранического фосфора было на уровне 3,43 и 2,64 мг на 100 мл плазмы. По окончании исследования он вернулся к своей обычной диете, и уровень фосфора в его крови через полгода составлял уже 4,2 мг/100 мл. Можнопредположить, что снижение фосфатов в организме произошло как по причине дефицита «незаменимых» ненасыщенных жирных кислот, так и благодаря приему высоких доз сахарозы.
В 2000 году убежденные в опасных для здоровья свойствах фруктозы исследователи высказали предположение, что переход на рацион с дефицитом магния усилит вред, наносимый фруктозой. И одиннадцать человек приняли участие в полугодовом эксперименте, в течение которого получали питание с высоким содержанием кукурузного крахмала или сиропа, богатыми фруктозой. Им также давали другие типичные американские продукты либо с чрезвычайно низким содержанием магния, либо с некоторым его дефицитом. Вывод, к которому пришли исследователи, был четко прописан в названии их статьи и состоял в том, что описанная выше комбинация существенно ухудшает минеральный баланс в теле.
Однако, в контексте результатов других исследований, касающихся действия фруктозы на фосфаты, я не считаю упомянутые выше выводы верными. Даже в случае чрезвычайно бедной магнием диеты баланс и магния, и кальция был положительным, из чего можно сделать вывод о том, что в среднем организмы испытуемых потребляли очень мало кальция и магния, люди в возрасте от 22 до 40, по-видимому, не очень сильно растут.
При стабильном потреблении как кальция, так и магния, со значительным превышением усваиваемого уровня кальция, можно предположить, что минералы были усвоены в костях. Однако, в случае «высокофруктозной» диеты баланс фосфата был у них в незначительной степени отрицательным. Если бы сахар оказывал такое же действие, как и в эксперименте с Уильямом Брауном в 1938 году (и в экспериментах на животных), то некоторое снижение фосфата можно было бы объяснить уменьшением его количества в крови и других жидкостях, но по мере продолжения эксперимента это явление на каком-то этапе должно было отражать и изменения в составе костей. Когда в жидкостях тела содержится больше углекислого газа, то карбонат кальция может депонироваться в костях (Messier и др., 1979). Повышение уровня углекислого газа может приводить к длительному отрицательному балансу фосфата за счет роли, которую углекислый газ играет в биохимии костей при взаимодействии с кальцием и магнием.
Еще одно важное свойство углекислого газа — это его способность регулировать одновременно и кальций, и фосфат, повышая абсорбцию и удержание кальция (Canzanello и др., 1995) и усиливая выделение фосфата. Повышенные концентрации углекислоты (как растворенного газа) и бикарбоната (бикарбоната натрия) приводят к усиленному выделению фосфатов в моче, даже при отсутствии паратгормона. Если концентрация сывороточного бикарбоната находится ниже нормальных значений, то значительно возрастает реабсорбция фосфатов почками (Jehle и др., 1999). Ацетазоламид увеличивает удержание углекислого газа организмом, увеличивая выведение фосфатов с мочой. Большая доля кальция в крови — это положительно заряженный комплекс, состоящий из кальция и бикарбоната, его заряд равен единице (Hughes и др., 1984). Неумение обращаться с этой комплексной формой кальция приводит к ошибкам и при определении уровня кальция в крови, и при интерпретации его физиологического воздействия, включая его действие в межклеточном пространстве. Гипервентиляция может приводить скелетные мышцы в судорожное состояние, сужать ковеносные сосуды, возбуждать тромбоциты и другие клетки; удаление углекислого газа из крови снижает концентрацию угольной кислоты, изменяя состояние и функцию кальция. Гипервентиляция приводит к росту фосфата и паратгормона, снижает содержание кальция (Krapf и др., 1992).
Поскольку эстроген имеет тенденцию вызывать гипервентиляцию, а значит и снижение концентрации углекислого газа, его роль в метаболизме фосфата следует изучить более тщательно. В работах Han и др. (2002) и Xu и др. (2003) было показано, что эстроген увеличивает реабсорбцию фосфата почками, но эстроген также приводит и к росту кортизола, который снижает реабсорбцию, поэтому следует принимать во внимание влияние эстрогена на весь организм в целом.
Солюбилизирующее влияние на кальций со стороны бикарбоната в сочетании с его способностью к фосфатурии, возможно, является причиной расслабляющего действия углекислого газа на кровеносные сосуды и гладкую бронхиальную мускулатуру, а также лежит в основе механизма предотвращения кальцификации сосудов гормоном щитовидной железы (Sato и др., 2005, Tatar, 2009, Kim и др., 2012). Эластичность сосудов и сердца усиливается углекислым газом и, напротив, снижена при гипотиреозе, сердечной недостаточности и под действием фосфата.
Фруктоза не только снижает концентрацию фосфата в межклеточном пространстве, но также снижает его количество, усваиваемое в желудочно-кишечном тракте из пищи (Kirchner и др., 2008), а исследования Милна-Нильсена приводят к заключению, что она также повышает потерю фосфата через почки. «Антивозрастной» белок клото повышает способность почек выводить фосфат и, подобно фруктозе, он поддерживает энергопроизводство и термогенез (Mori и др., 2000).
Снижение фосфата в крови приводит к снижению паратгормона. Паратгормон, препятствуя реабсорбции фосфата почками, приводит к выработке серотонина тучными клетками (а серотонин увеличивает почечную реабсорбцию фосфата) и, возможно, обладает другими противовоспалительными свойствами. Например, делеция ПТГ гена компенсирует негативные последствия (ускоренная кальцификация и остеопороз) делеции гена клото, как выяснилось, путем предотвращения роста остеопонтина (Yuan и др., 2012).
Ниацинамид — это еще один нутриент, который снижает сывороточный фосфат (Cheng и др., 2008), подавляя его всасывание в кишечнике (Katai и др., 1989) и снижая его реабсорбцию в почках (Campbell и др., 1989). Возможно, способность ниацинамида снижать уровень свободных жирных кислот за счет ингибирования липолиза может играть роль и в процессе его влияния на фосфат (по аналогии с фосфатопонижающим действием при дефиците полиненасыщенных жирных кислот). Аспирин — еще одно противолиполитическое средство (de Zentella и др., 2002), которое стимулирует выработку энергии из сахара и снижает фосфат, возможно, способствуя удержанию магния (Yamada и Morohashi, 1986).
Диета, содержащая достаточное для ограничения активности паращитовидных желез количество кальция и низкое количество фосфата и полиненасыщенных жиров, в которой в качестве основного источника углеводов используется сахар, а не крахмал, а также с возможными добавками аспирина и ниацинамида, должна содействовать борьбе с дегенеративными процессами, связанными с высоким уровнем фосфата: слабостью, сердечной недостаточностью, дискоординацией движений, гипогонадизмом, бесплодием, кальцификацией сосудов, эмфиземой, раком, остеопорозом, атрофией кожи, скелетных мышц, кишечника, тимуса и селезенки (Ohnishi и Razzaque, 2010; Shiraki-Iida и др., 2000; Kuro-o и др., 1997; Osuka и Razzaque, 2012).Продукты, наиболее богатые фосфатом относительно содержания в них кальция, — это мюсли, бобовые, мясо и рыба. Фосфат добавляют во многие полуфабрикаты. Продукты с более высоким, безопасным соотношением кальция и фосфата — это листья капусты и свеклы, многие фрукты, молоко и сыр. Кофе, будучи хорошим источником магния, по-видимому, весьма эффективен в деле снижения фосфата за счет своего антагонизма к аденозину (Coulson и др., 1991).
Хотя повышенный фосфат обычно приводит к кальцификации сосудов (повышается их жесткость и, соответственно, растет систолическое давление крови), в случае, когда основная часть фосфата поступает с пищей из молока и сыра, эпидемиологичски его действие связывают со снижением кровяного давления (Takeda и др., 2012).
Токсичность фосфата приводит к некоторым весьма интересным выводам, касающимся стресса и старения и помогающим объяснить защитное действие углекислого газа, гормона щитовидной железы, сахара, ниацинамида и кальция. Его токсичность наводит на мысль о том, что следует внимательно изучить влияние других натуральных продуктов, используемых в качестве пищевых добавок. Например, избыток лимонной кислоты может активировать дремлющие раковые клетки (Havard и др., 2011) и приводить к их злокачественности (Blüml и др., 2011).Вообще говоря, исследования по установлению оптимальных соотношений между минералами, жирами, аминокислотами и другими веществами в продуктах питания, а также изучение их взаимодействия с натуральными токсинами, антинутриентами и веществами, разрушающими гормональную систему организма, едва начались. опубликовано
© Рей Пит
P.S. И помните, всего лишь изменяя свое потребление — мы вместе изменяем мир! ©
Источник: //ekiri22.blogspot.com/2015/02/blog-post.html
Портал БАШНЯ. Копирование, Перепечатка возможна при указании активной ссылки на данную страницу.