942
Літій-іонні акумулятори 25 років
Цього року відзначає 25 років з моменту виходу перших літій-іонних батарей, виготовлених Sony в 1991 році. За чверті століття, їх потужність майже вдвічі зросла від 110 Вт / кг до 200 Вт / кг, але незважаючи на такий екстремальний прогрес і численні дослідження електрохімічних механізмів, сьогодні хімічні процеси і матеріали всередині літієво-іонних батарей практично однакові, як і 25 років тому. У статті роз’ясовано, як було створено та розв’язано, а також труднощі, які стикаються розробниками нових матеріалів.

1,1 км Технологічний розвиток: 1980-2000
Повернувшись до 70-х років, вчені знайшли, що є матеріали, які називаються халькогенідами (наприклад, MoS2), які здатні революційно реагувати з іонами літію, інтегруючи їх у структуру кристала. При цьому запропоновано перший прототип літій-іонного акумулятора, що складається з халкогенідів на катоді та металевих літій при аноді. Теоретично, під час розряду, літійські іони «випущені» анодом повинні бути включені в шаровану структуру MoS2, а при зарядженні, осідати на аноді, повертатися до початкового стану.
Але перші спроби створити такі акумулятори були невдалими, так як при зарядці літійських іонів не хочуть перевернути в плоску пластину металевого літію, і оселилися на аноді, як це сталося, що призводить до зростання дендритів (вінів металевого літію), короткого замикання і вибуху батарей. Це було слідом за етапом детального дослідження реакції міжкаляцій (покладання літію в кристалах з спеціальною структурою), що дозволило замінити літій-метал з вуглецем: спочатку з коксом, а потім з графітом, який ще використовується сьогодні, а також має шаровану структуру, здатну покладання іонів літію.
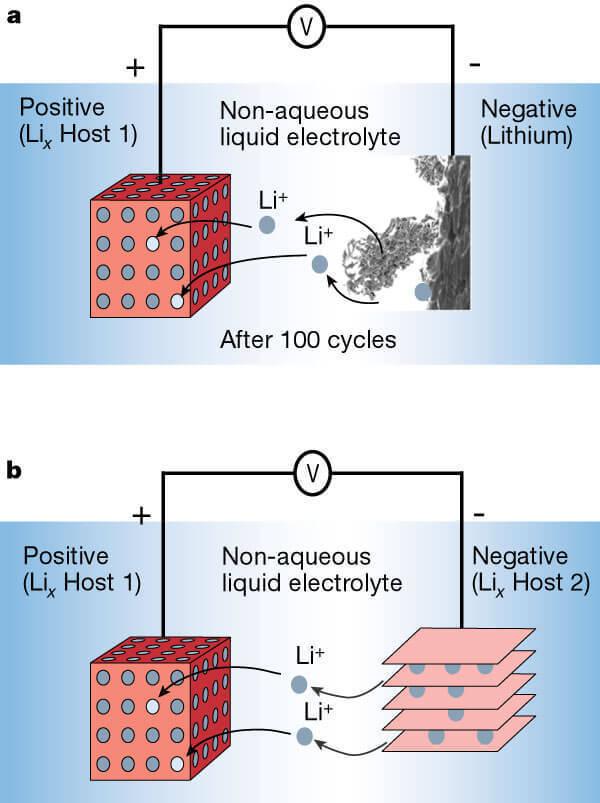
Літій-іонний акумулятор з літій-металевим анодом (a) і шарованим анодом (b).
Коли вчені почали використовувати вуглецеві матеріали на аноді, вони зрозуміли, що природа дала людство великий подарунок. На графітіті, при першому заряді утворюється захисний шар декомпонованої електроліту, який називається SEI (Solid Electrolyte Інтерфейс). Точний механізм його утворення і композиції ще не повністю зрозумілий, але відомо, що без цього унікального пасивного шару електроліту продовжить декомпозицію на аноді, електрод буде згортатися, а акумулятор стане непотрібним. Так з'явився перший робочий анод на основі вуглецевих матеріалів, який був випущений на продаж в складі літієво-іонних батарей в 90-х роках.
Симулятивно з анодом, катодом також був модифікований: виявилося, що не тільки халькогеніди, але і деякі переходи металеві оксиди, такі як LiMO2 (M = Ni, Co, Mn), мають шаровану структуру, здатну згортання іонів літію, які не тільки стійкі хімічні, але і дозволяють створювати клітинки з більш високою напругою. LiCoO2 використовується в катоді першого комерційного прототипу акумулятора.
771250Р.
2,2 км Нові реакції та мода для наноматеріалів: 2000-2010
У 2000-х рр. розпочалася наноматеріали. Природно, прогрес в нанотехнологіях не обходить літій-іонних батарей. І це завдяки їм, які вчені зробили матеріал абсолютно непридатним для цієї технології, LiFePO4, одного з лідерів у використанні електромобільних акумуляторів у катавідах.
І те, що звичайні, об'ємні частинки заліза фосфату проводять іони дуже погано, а їх електрона провідність дуже низька. Але наноструктурований літій не повинен подорожувати тривалими відстанями, щоб вписуватися в нанокристал, тому перекриття набагато швидше, а покриття нанокристалів з тонкою вуглецевою плівкою покращує їх провідність. В результаті на продаж прийшли не тільки небезпечний матеріал, який не випускає кисню при високих температурах (наприклад, оксидах), але і матеріал, який має можливість працювати при більш високих струмах. Саме тому виробники автомобілів віддають перевагу цьому катодному матеріалу, незважаючи на незначну ємність, ніж LiCoO2.
У той же час вчені шукали нові матеріали, які взаємодіють з літією. І як виявилося, переобладнання, або тиснення літію в кристал, не єдиний варіант реакції на електроди в літій-іонних акумуляторах. Наприклад, деякі елементи, а саме Сі, Сн, Сб і т.д., утворює «легкий» літію при використанні в аноді. Ємність такої електроди становить 10 разів вище, ніж місткість графіту, але є одним «але»: такий електрод при формуванні сплаву значно збільшується в обсязі, що призводить до її швидкого розтріскування і стає непридатним. І для зменшення механічної напруги електрода з таким збільшенням обсягу, елемент (наприклад, кремнієвий) пропонується використовувати у вигляді наночастинок, укладених в вуглецеву матрицю, яка «дозає» зміни обсягу.

Але об'ємні зміни не є єдиною проблемою сплавно-формувальних матеріалів і перешкоджають їх поширенню. Як зазначено вище, графіт формує «від природи» – ДПІ. І на матеріалах, які утворюють сплав, електролітні декомпозиції постійно і збільшують стійкість електроду. Проте ми з часом бачимо в новинах, які деякі батареї використовують кремнієвий анод. Так, кремній використовується в ньому, але в дуже малих кількостях і змішаних з графітом, так що «посередні ефекти» не дуже помітні. Природно, коли кількість кремнію в аноді становить лише кілька відсотків, а решта – графіт, значне збільшення потужності не буде працювати.
І якщо тема анодів, формуючи сплави, зараз розвивається, то деякі дослідження почалися в останнє десятиліття, дуже швидко прийшли до мертвого кінця. Це стосується так званих реакцій перетворення. У цій реакції деякі металеві сполуки (оксиди, нітриди, сульфати та ін.) взаємодіють з літією, перетворюючи в метал, змішаний з літійськими сполуками:
Максб ==> aM + bLinX
М: метал
X: O, N, C, S ...
І, як ви можете уявити, з матеріалом під час цієї реакції відбуваються такі зміни, що навіть кремній не мріяв. Наприклад, оксид кобальту перетворюється в наночастинки металіків кобальту, укладені в матрицю оксидів літію:
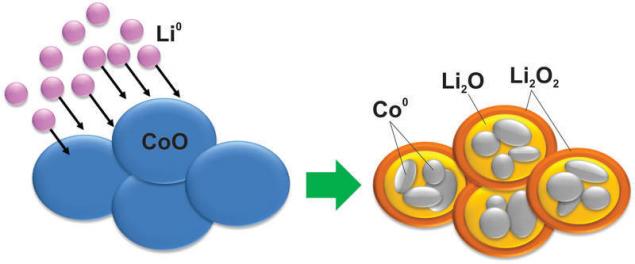
Природно, ця реакція погано реверсується, крім того, існує велика різниця напруги між зарядкою і розрядом, що робить такі матеріали без використання в додатку.
Цікаво відзначити, що при відкритті цієї реакції сотні статей на тему почали публікуватися в наукових виданнях. Але тут я хотів би процитувати професора Тараскону Коледжа де Франсу, який заявив, що «пошукові реакції були реальні поля експериментації для дослідження матеріалів з наноархітектурою, які дав можливість науковцям зробити красиві фотографії за допомогою напівпрозорого електрону мікроскопу і публікувати в відомих журналах, незважаючи на абсолютну непотрібність цих матеріалів. й
У підсумку, хоча сотні нових електродних матеріалів були синтезовані за останні десятиріччя, акумулятори все ще використовують майже ті ж матеріали, що і вони зробили 25 років тому. Так чому це сталося?
3. У Подарунок: Основні труднощі розвитку нових батарейок.
Як ви можете побачити, в наведеній вище екскурсії в історію літієво-іонних акумуляторів, не слово було про це ще один важливий елемент: електроліт. І існує причина цього: електроліт не змінився протягом 25 років, і не існує можливості. Сьогодні, як в 90-х, літієвих солей (головно LiPF6) використовуються як електроліт в органічному вуглецевому розчині (етилен карбонат (EC) + діметил карбонат (DMC)). Але це через електроліт, який прогрес у збільшенні потужності акумулятора сповільнився за останні роки.
Щоб надати конкретний приклад: сьогодні є матеріали для електродів, які можуть значно збільшити потужність літій-іонних батарей. До них відносяться, наприклад, LiNi0.5Mn1.5O4, які зроблять акумулятор з напругою клітинки 5 Volts. Але алас, в таких діапазонах напруги, електроліт на основі карбонату стає нестабільним. Або ще один приклад: як зазначено вище, сьогодні, для того, щоб використовувати значні кількості кремнію (або інші метали, які утворюють сплави з літією) в аноді, один з основних проблем необхідно вирішити: формування пасивного шару (SEI), що дозволить запобігти безперервному розкладання електроліту і руйнування електроду, а для цього необхідно розробити принципово новий склад електроліту. Але чому так важко знайти альтернативу існуючому складу, адже літійські солі рясніють, а органічні розчинники досить складно?
І складність полягає в тому, що електроліт повинен одночасно мати такі характеристики:
Паралельно з удосконаленням існуючих технологій, вчені працюють на принципово нові рішення. І ці розчини можна зменшити на спробу позбутися від розчинника рідини на основі карбонатів. До таких технологій відносяться, наприклад, іонні рідини. Іонні рідини в основному розплавлені солі, які мають дуже низьку точку плавлення, і деякі з них навіть при кімнатній температурі залишаються рідкими. І це тому, що ці солі мають особливу, стерично складну структуру, яка ускладнена кристалізація.
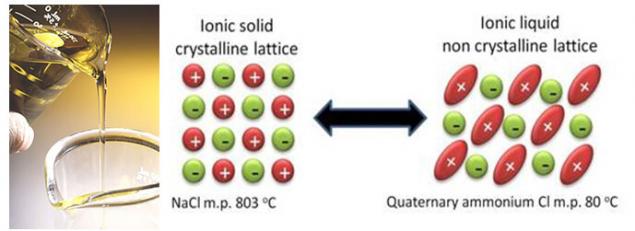
Здавалося б, дуже велика ідея повністю виключити розчинник, який в'яжеться і вводить в паразитичні реакції з літією. Але насправді, усунення розчинника створює більше проблем, ніж він вирішує. По-перше, в звичайних електролітах, частина розчинника «сама себе» для побудови захисного шару на поверхні електродів. А компоненти іонних рідин ще не справляються з цим завданням (аніони, до речі, можуть також ввести в паразитичні реакції з електродами, як розчинники). По-друге, дуже важко знайти іонну рідину з правильним цибулею, так як вони впливають не тільки точка плавлення солі, але і електрохімічна стійкість. Алас, найбільш стабільні аніони утворюють солі, які розтоплюють при високих температурах і навпаки.
Ще одним способом позбутися від вуглецевих розчинників є використання твердих полімерів (наприклад, поліефірів), які ведуть літію, яка б, спочатку, мінімізувати ризик витікання електролітів, а також запобігти знеціненням з вирощування при використанні літієвого металу на аноді. Але основна складність, що стикається з творцями полімерних електролітів, є їх дуже низькою іонною провідністю, оскільки іони літію важко пересуватися в такому в'язкому середовищі. Це, звичайно, сильно обмежує потужність батарей. Зменшення в'язкості тягне за собою проростання дендритів.

Дослідники також вивчають тверді неорганічні речовини, які проводять літію за допомогою дефектів кристала, і намагаються застосовувати їх як електроліти для літій-іонних батарей. Така система з першого погляду ідеально підходить: хімічна та електрохімічна стійкість, термостійкість та механічна міцність. Але ці матеріали, знову, мають дуже низьку іонну провідність, і доцільно використовувати їх тільки у вигляді тонких плівок. Крім того, такі матеріали найкраще підходять при високій температурі. Нарешті, з твердою електролітою дуже важко створити механічний контакт між електролітом і електродами (в цій області рідкі електроліти не мають рівних).
4. Висновки.
З моменту виходу літієво-іонних батарей, спроби збільшення їх ємності не зупиняються. Але збільшення потужності уповільнюється в останні роки, незважаючи на сотні нових електродних матеріалів, які пропонуються. І те, що більшість з цих нових матеріалів сидять на полиці, чекаючи нового електроліту, щоб приїхати разом. На мій погляд, розвиток нових електролітів є набагато складніше завдання, ніж розробка нових електродів, так як необхідно враховувати не тільки електрохімічні властивості самого електроліту, але і всі його взаємодії з електродами. В цілому, читання новин, таких як «новий супер електрод», необхідно перевірити, як такий електрод взаємодіє з електролітом, і чи підходить електроліт для такої електроди за принципом. Видання
Джерело: geektimes.ru/post/282424/

1,1 км Технологічний розвиток: 1980-2000
Повернувшись до 70-х років, вчені знайшли, що є матеріали, які називаються халькогенідами (наприклад, MoS2), які здатні революційно реагувати з іонами літію, інтегруючи їх у структуру кристала. При цьому запропоновано перший прототип літій-іонного акумулятора, що складається з халкогенідів на катоді та металевих літій при аноді. Теоретично, під час розряду, літійські іони «випущені» анодом повинні бути включені в шаровану структуру MoS2, а при зарядженні, осідати на аноді, повертатися до початкового стану.
Але перші спроби створити такі акумулятори були невдалими, так як при зарядці літійських іонів не хочуть перевернути в плоску пластину металевого літію, і оселилися на аноді, як це сталося, що призводить до зростання дендритів (вінів металевого літію), короткого замикання і вибуху батарей. Це було слідом за етапом детального дослідження реакції міжкаляцій (покладання літію в кристалах з спеціальною структурою), що дозволило замінити літій-метал з вуглецем: спочатку з коксом, а потім з графітом, який ще використовується сьогодні, а також має шаровану структуру, здатну покладання іонів літію.

Літій-іонний акумулятор з літій-металевим анодом (a) і шарованим анодом (b).
Коли вчені почали використовувати вуглецеві матеріали на аноді, вони зрозуміли, що природа дала людство великий подарунок. На графітіті, при першому заряді утворюється захисний шар декомпонованої електроліту, який називається SEI (Solid Electrolyte Інтерфейс). Точний механізм його утворення і композиції ще не повністю зрозумілий, але відомо, що без цього унікального пасивного шару електроліту продовжить декомпозицію на аноді, електрод буде згортатися, а акумулятор стане непотрібним. Так з'явився перший робочий анод на основі вуглецевих матеріалів, який був випущений на продаж в складі літієво-іонних батарей в 90-х роках.
Симулятивно з анодом, катодом також був модифікований: виявилося, що не тільки халькогеніди, але і деякі переходи металеві оксиди, такі як LiMO2 (M = Ni, Co, Mn), мають шаровану структуру, здатну згортання іонів літію, які не тільки стійкі хімічні, але і дозволяють створювати клітинки з більш високою напругою. LiCoO2 використовується в катоді першого комерційного прототипу акумулятора.
771250Р.
2,2 км Нові реакції та мода для наноматеріалів: 2000-2010
У 2000-х рр. розпочалася наноматеріали. Природно, прогрес в нанотехнологіях не обходить літій-іонних батарей. І це завдяки їм, які вчені зробили матеріал абсолютно непридатним для цієї технології, LiFePO4, одного з лідерів у використанні електромобільних акумуляторів у катавідах.
І те, що звичайні, об'ємні частинки заліза фосфату проводять іони дуже погано, а їх електрона провідність дуже низька. Але наноструктурований літій не повинен подорожувати тривалими відстанями, щоб вписуватися в нанокристал, тому перекриття набагато швидше, а покриття нанокристалів з тонкою вуглецевою плівкою покращує їх провідність. В результаті на продаж прийшли не тільки небезпечний матеріал, який не випускає кисню при високих температурах (наприклад, оксидах), але і матеріал, який має можливість працювати при більш високих струмах. Саме тому виробники автомобілів віддають перевагу цьому катодному матеріалу, незважаючи на незначну ємність, ніж LiCoO2.
У той же час вчені шукали нові матеріали, які взаємодіють з літією. І як виявилося, переобладнання, або тиснення літію в кристал, не єдиний варіант реакції на електроди в літій-іонних акумуляторах. Наприклад, деякі елементи, а саме Сі, Сн, Сб і т.д., утворює «легкий» літію при використанні в аноді. Ємність такої електроди становить 10 разів вище, ніж місткість графіту, але є одним «але»: такий електрод при формуванні сплаву значно збільшується в обсязі, що призводить до її швидкого розтріскування і стає непридатним. І для зменшення механічної напруги електрода з таким збільшенням обсягу, елемент (наприклад, кремнієвий) пропонується використовувати у вигляді наночастинок, укладених в вуглецеву матрицю, яка «дозає» зміни обсягу.

Але об'ємні зміни не є єдиною проблемою сплавно-формувальних матеріалів і перешкоджають їх поширенню. Як зазначено вище, графіт формує «від природи» – ДПІ. І на матеріалах, які утворюють сплав, електролітні декомпозиції постійно і збільшують стійкість електроду. Проте ми з часом бачимо в новинах, які деякі батареї використовують кремнієвий анод. Так, кремній використовується в ньому, але в дуже малих кількостях і змішаних з графітом, так що «посередні ефекти» не дуже помітні. Природно, коли кількість кремнію в аноді становить лише кілька відсотків, а решта – графіт, значне збільшення потужності не буде працювати.
І якщо тема анодів, формуючи сплави, зараз розвивається, то деякі дослідження почалися в останнє десятиліття, дуже швидко прийшли до мертвого кінця. Це стосується так званих реакцій перетворення. У цій реакції деякі металеві сполуки (оксиди, нітриди, сульфати та ін.) взаємодіють з літією, перетворюючи в метал, змішаний з літійськими сполуками:
Максб ==> aM + bLinX
М: метал
X: O, N, C, S ...
І, як ви можете уявити, з матеріалом під час цієї реакції відбуваються такі зміни, що навіть кремній не мріяв. Наприклад, оксид кобальту перетворюється в наночастинки металіків кобальту, укладені в матрицю оксидів літію:

Природно, ця реакція погано реверсується, крім того, існує велика різниця напруги між зарядкою і розрядом, що робить такі матеріали без використання в додатку.
Цікаво відзначити, що при відкритті цієї реакції сотні статей на тему почали публікуватися в наукових виданнях. Але тут я хотів би процитувати професора Тараскону Коледжа де Франсу, який заявив, що «пошукові реакції були реальні поля експериментації для дослідження матеріалів з наноархітектурою, які дав можливість науковцям зробити красиві фотографії за допомогою напівпрозорого електрону мікроскопу і публікувати в відомих журналах, незважаючи на абсолютну непотрібність цих матеріалів. й
У підсумку, хоча сотні нових електродних матеріалів були синтезовані за останні десятиріччя, акумулятори все ще використовують майже ті ж матеріали, що і вони зробили 25 років тому. Так чому це сталося?
3. У Подарунок: Основні труднощі розвитку нових батарейок.
Як ви можете побачити, в наведеній вище екскурсії в історію літієво-іонних акумуляторів, не слово було про це ще один важливий елемент: електроліт. І існує причина цього: електроліт не змінився протягом 25 років, і не існує можливості. Сьогодні, як в 90-х, літієвих солей (головно LiPF6) використовуються як електроліт в органічному вуглецевому розчині (етилен карбонат (EC) + діметил карбонат (DMC)). Але це через електроліт, який прогрес у збільшенні потужності акумулятора сповільнився за останні роки.
Щоб надати конкретний приклад: сьогодні є матеріали для електродів, які можуть значно збільшити потужність літій-іонних батарей. До них відносяться, наприклад, LiNi0.5Mn1.5O4, які зроблять акумулятор з напругою клітинки 5 Volts. Але алас, в таких діапазонах напруги, електроліт на основі карбонату стає нестабільним. Або ще один приклад: як зазначено вище, сьогодні, для того, щоб використовувати значні кількості кремнію (або інші метали, які утворюють сплави з літією) в аноді, один з основних проблем необхідно вирішити: формування пасивного шару (SEI), що дозволить запобігти безперервному розкладання електроліту і руйнування електроду, а для цього необхідно розробити принципово новий склад електроліту. Але чому так важко знайти альтернативу існуючому складу, адже літійські солі рясніють, а органічні розчинники досить складно?
І складність полягає в тому, що електроліт повинен одночасно мати такі характеристики:
- Він повинен бути хімічно стійким під час терміну служби акумулятора, а також, він повинен бути стійким до окислення катоду і зниженням аноду. Це означає, що спроби збільшити інтенсивність енергії акумулятора, тобто використання ще більш окислювальних катаходів і зменшення анодів, не повинно привести до розкладання електроліту.
- Електроліт повинен також мати хорошу іонну провідність і низьку в'язкість для транспортування іонів літію за широким діапазоном температур. Саме тому DMC додано до в'язкої етиленової карбонату з 1994 року.
- Сіль літію добре розчиняється в органічному розчиннику.
- Електроліт повинен сформувати ефективний прохідний шар. Етилен карбонат робить це добре, в той час як інші розчинники, такі як пропілен карбонат, який був спочатку протестований Sony, знищити структуру аноду, так як він вбудований в нього паралельно з літією.
Паралельно з удосконаленням існуючих технологій, вчені працюють на принципово нові рішення. І ці розчини можна зменшити на спробу позбутися від розчинника рідини на основі карбонатів. До таких технологій відносяться, наприклад, іонні рідини. Іонні рідини в основному розплавлені солі, які мають дуже низьку точку плавлення, і деякі з них навіть при кімнатній температурі залишаються рідкими. І це тому, що ці солі мають особливу, стерично складну структуру, яка ускладнена кристалізація.

Здавалося б, дуже велика ідея повністю виключити розчинник, який в'яжеться і вводить в паразитичні реакції з літією. Але насправді, усунення розчинника створює більше проблем, ніж він вирішує. По-перше, в звичайних електролітах, частина розчинника «сама себе» для побудови захисного шару на поверхні електродів. А компоненти іонних рідин ще не справляються з цим завданням (аніони, до речі, можуть також ввести в паразитичні реакції з електродами, як розчинники). По-друге, дуже важко знайти іонну рідину з правильним цибулею, так як вони впливають не тільки точка плавлення солі, але і електрохімічна стійкість. Алас, найбільш стабільні аніони утворюють солі, які розтоплюють при високих температурах і навпаки.
Ще одним способом позбутися від вуглецевих розчинників є використання твердих полімерів (наприклад, поліефірів), які ведуть літію, яка б, спочатку, мінімізувати ризик витікання електролітів, а також запобігти знеціненням з вирощування при використанні літієвого металу на аноді. Але основна складність, що стикається з творцями полімерних електролітів, є їх дуже низькою іонною провідністю, оскільки іони літію важко пересуватися в такому в'язкому середовищі. Це, звичайно, сильно обмежує потужність батарей. Зменшення в'язкості тягне за собою проростання дендритів.

Дослідники також вивчають тверді неорганічні речовини, які проводять літію за допомогою дефектів кристала, і намагаються застосовувати їх як електроліти для літій-іонних батарей. Така система з першого погляду ідеально підходить: хімічна та електрохімічна стійкість, термостійкість та механічна міцність. Але ці матеріали, знову, мають дуже низьку іонну провідність, і доцільно використовувати їх тільки у вигляді тонких плівок. Крім того, такі матеріали найкраще підходять при високій температурі. Нарешті, з твердою електролітою дуже важко створити механічний контакт між електролітом і електродами (в цій області рідкі електроліти не мають рівних).
4. Висновки.
З моменту виходу літієво-іонних батарей, спроби збільшення їх ємності не зупиняються. Але збільшення потужності уповільнюється в останні роки, незважаючи на сотні нових електродних матеріалів, які пропонуються. І те, що більшість з цих нових матеріалів сидять на полиці, чекаючи нового електроліту, щоб приїхати разом. На мій погляд, розвиток нових електролітів є набагато складніше завдання, ніж розробка нових електродів, так як необхідно враховувати не тільки електрохімічні властивості самого електроліту, але і всі його взаємодії з електродами. В цілому, читання новин, таких як «новий супер електрод», необхідно перевірити, як такий електрод взаємодіє з електролітом, і чи підходить електроліт для такої електроди за принципом. Видання
Джерело: geektimes.ru/post/282424/
Алмазні акумулятори перетворять радіоактивні відходи в чисту енергію
SolarStratos: сонячні літаки, які зростуть в стратосферу