940
锂离子电池是25岁
今年是25年以来所释放的第一锂离子电池,其产生的索尼公司在1991年。 四分之一个世纪,他们的能力几乎增加了一倍,从110WH/公斤至200WH/公斤,但尽管如此巨大的进展和无数的研究的电化学电机制、化学过程和材料在锂离子电池是几乎相同25年前。 在这篇文章中,你会学习如何形成和发展的这种技术和面临的挑战,开发新的材料。

1. 发展的技术:1980-2000
早在上世纪70年代,科学家们已确定,有资料称为硫(例如,MoS2),从而可以进入可逆反应与锂离子通过将它们纳入它的层状晶体结构。 立即提供的第一个原型锂离子电池组成的硫在阴极和锂金属电极。 从理论上讲,放电期间,锂离子,"发布"极应嵌入的分层结构的MoS2,并充当解决在阳极,回到原来的状态。
但是第一次尝试建立这样的电池是不成功的时充,锂离子不想回到一个平板的金属锂,并决定作为阳极的打击,导致生长的树(链的锂金属)、短路和防爆的电池。 这是随后阶段的详细研究的反应插入(嵌入的锂在有特殊晶体结构),允许替换的金属锂在碳:第一个焦炭和石墨,这是使用,直到现在还设有一个分层的结构,能够纳入锂离子。
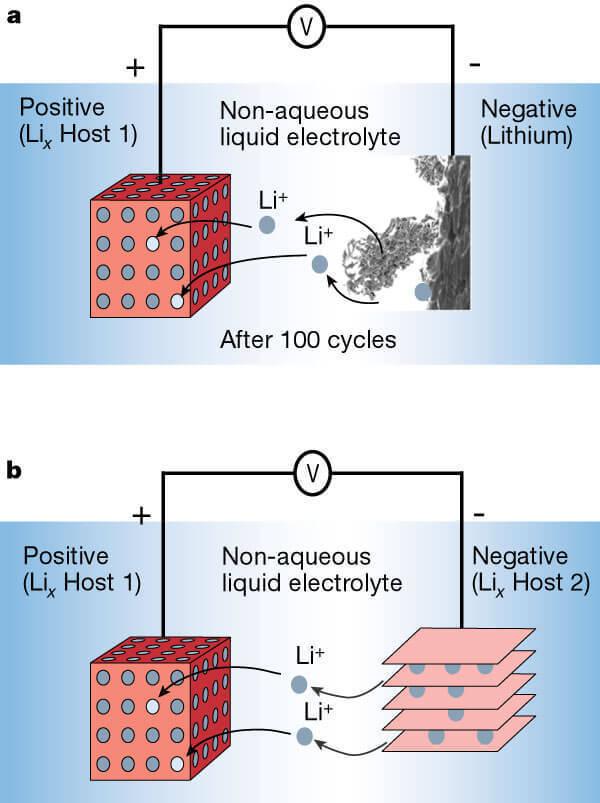
锂离子电池阳极的锂金属(a)和阳极的层物质(b)。
开始使用碳材料为阳极,科学家们意识到,性质已经做了人类的伟大礼物。 石墨,当第一个充,形成一个保护层分解电解质的,称为SEI(固体电接口)。 的确切机制,其形成和组成仍未完全理解,但我们知道,没有这种独特的钝化层,电解质仍然分解,在阳极将被销毁,电池将来成年久失修。 因此,有第一工作阳极的基于碳材料,这是释放在组合物锂离子电池在90-当中。
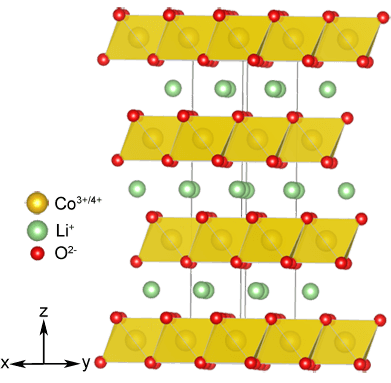
同时,与修改阳极和阴极:事实证明,一个分层的结构是能够纳入锂离子,不仅硫和某些转型金属氧化物,如LiMO2(M=镍、钴、锰),这不仅是更为稳定的化学,但也允许创造细胞有更高的电压。 这LiCoO2被使用的阴极的第一个商业原型电池。
2. 新的反应,与时尚有关纳米材料:2000-2010年
在2000年,科学繁荣的纳米材料。 当然,进展纳米技术是不能幸免和锂离子电池。 并感谢他们,科学家们提出了绝对会似乎不适合这种技术材料,LiFePO4,一个领导人在使用电阴极电池。
但事情是,普通的,三个维颗粒Jelisaveta非常糟糕的开展离子和电子传导性非常低。 但是,由于一连串的nanostructuring是没有必要移动大距离,以适应进入纳米,因此插入一个更快和涂层的纳米薄碳膜提高了它的导电性。 导致销售不仅是少危险材料,不排放的氧气在较高的温度(如氧化物),而且还材料具有能力操作较高的电流。 因此,这种阴极材料制造商喜欢汽车的,尽管略低容量比LiCoO2。
同时,科学家寻找新的材料,进行交互与锂。 而且,事实证明,插入或嵌入的锂片是不是唯一的选择反应极中的锂离子电池。 例如,某些要素,即Si,Sn,Sb等, 形成一个"合金"锂当用在阳极。 有能力这一极为10倍的容量的石墨,但是有一个"但是":这样的一个电极的过程中形成的合金大大增加量,这会导致迅速裂和未来的成年久失修。 为了减少机械压力的极与这种增加,素(例如硅)建议使用的形式纳米粒子的封闭式中碳基体"吸收"变化中的体积。

但是变化的积不是唯一的问题的材料形成合金,并防止其广泛应用。 如上所述,石墨是形成"大自然的恩赐"-SEI。 和材料形成合金电解质分解地连续和增加抵抗极。 但尽管如此,周期性地在我们看到的消息说,一些电池中使用的"硅极"的。 是的,硅在使用它,但是在非常小的数量和混合与石墨的副作用是不太明显。 当然,当量的硅在阳极中只有百分之几,其余的石墨,显着增加的能力将不会的工作。
如果主题的阳极形式的合金,是现在发展中,一些研究,开始在过去十年中,很快来到了一个陷入瘫痪。 这适用,例如,所谓的转换反应。 在此反应中,一些化合物的金属(氧化物、氮化物、硫化物,等等)。 与锂,变成金属混合,用锂化合物:
MaXb==>:+bLinX
M:金属
X:O,N,C,S...
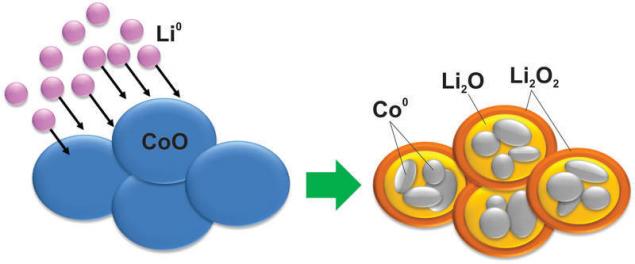
而且,正如你可以想象,与在这样的反应发生这样的变化,它甚至硅不是梦想。 例如,钴氧化变成钴金纳米粒子被包围在一个矩阵的氧化锂:
当然,这种反应不可逆转的相同之间的充电,并排放大电压差,使得这些材料没有用于应用程序。
有趣的是注意到,当这种反应是打开在科学期刊上开始公布的数百篇文章,关于这一主题。 但是然后hochetsja引用教授塔拉斯孔从法兰西学院,他说"反应转换是一个真实的实地实验研究材料的与nanoarchitectures给科学家的能力,使美丽的图像使用透射电子显微镜和出版着名的刊物,尽管绝对的实际无用这些材料。"
在一般情况下,总的来说,尽管事实上,在过去十年中,合成数以百计的新材料,用于电极的电池甚至使用几乎相同的材料为25年前。 为什么会发生?
3. 本挑战在于开发新的电池。
你可以看到在上述附记入历史的锂离子电池,没有一个字是说关于另一个,最重要的因素:电解质。 还有一个原因:电解质25年来几乎没有改变和工作的替代品的建议。 今天,在90-e年中,在形成的电解质的使用,锂盐(主要是LiPF6)的有机溶液中的碳酸盐(碳酸亚乙酯(EC)+二甲酯(DMC)项)。 但是因为电解质的进展,在增加的电池容量近年来有所放缓。
这里是一个例子:今天有材料的电极,这可能大大增加能力的锂离子电池。 这些包括,例如,LiNi0的。5Mn1的。5О4,这将使电池电压的单元在5伏。 但可惜的是,在压范围的电解质的基于碳变得不稳定。 或者另外一个例子:如上所述,今天使用了大量的硅(或其它形成金属合金,锂)在阳极,有必要解决的一个主要问题:形成为一个钝化层(SEI)这将防止连续分解电解质和破坏的电极,并为此我们需要发展一个根本的新组成的电解质。 但为什么这么难找到一个替代现有结构,之后,全的锂盐,和有机溶剂足够吗?!
和挑战构成了事实上的电解质应同时具备以下特点:
在与改进现有的技术,科学家们正在使一个全新的解决方案。 这些决定可以降低到试图摆脱的液中的溶剂的基础上的碳酸盐。 这些技术包括,例如,离子液体。 离子液体基本上是熔盐与熔点非常低,他们中有些人甚至在室温下保持液体。 和所有的事实,因为这些特殊盐,位阻结构,该结构将会复杂化的结晶。
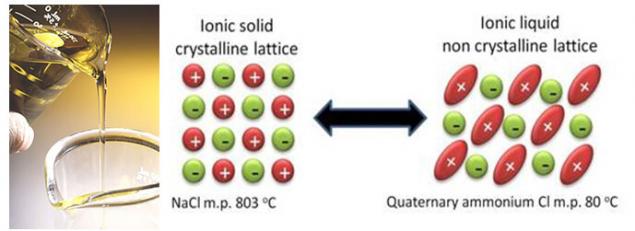
这似乎是一个伟大的想法完全消除的溶剂,其易燃性,并反应寄生反应的锂。 但事实上,消除溶剂造成的那一刻更多的问题比它解决的。 首先,在通常的电解质溶剂"牺牲自己"建立一个保护层,在电极上面。 作为部件的离子液体,与这个任务我还没有(阴离子,顺便说一句,还可以从事的寄生反应与电极,作为溶剂)。 其次,这是非常困难的选择离子液体用正确的阴离子,因为它们不仅影响的熔点盐而且还在化学稳定性。 唉,最稳定的阴离子,以盐的形式,熔在高温下,反之亦然。
另一种方法来摆脱该溶剂的基础上的碳酸盐-使用固体聚合物(例如聚酯)导锂,其中,首先,尽量减少风险的电解质泄漏出,并且会防止生长的树突时使用的金属锂在阳极。 但是,面临的主要问题的创造者聚合电解质是非常低的离子传导性,因为锂离子们难以移动在这样一种粘稠状的媒介。 当然,这大大限制了电源的蓄电池。 下粘度需要发芽的树突。

研究人员还研究的固体无机物质进行锂通过的缺陷的结晶,并尝试将它们应用在形成的电解质的锂离子电池。 这个系统乍一看是完美的:化学和化学稳定性、耐温度上升和机械力量。 但这些材料,再次非常低的离子电导率,并使用他们celesoobrazno仅在形成的薄膜。 此外,这种材料的最高温度。 最后,与一个坚实的电解质是非常困难的创造机械触点之间的电子和极(在该领域的液电解质不相等)。
4. 结论。
由于介绍的锂离子电池,试图增加他们的能力不会停止。 但在最近几年增加容量有所减缓,尽管数以百计的拟议的新材料的电极。 但事实是,大多数这些新材料"坐上架"等待,直到一个新的、适合电解质。 和开发新的电解质的-在我看来更复杂的任务于发展的新的电极,作为需要考虑的不仅是电化学性质,但也为其相互作用,与电极。 在一般情况下,阅读新闻,如"开发一个新的超级电极..."应该进行检查,例如电极与电解质,以及是否有针对这个极电解液是适合的原则。 出版
资料来源:geektimes.ru/post/282424/

1. 发展的技术:1980-2000
早在上世纪70年代,科学家们已确定,有资料称为硫(例如,MoS2),从而可以进入可逆反应与锂离子通过将它们纳入它的层状晶体结构。 立即提供的第一个原型锂离子电池组成的硫在阴极和锂金属电极。 从理论上讲,放电期间,锂离子,"发布"极应嵌入的分层结构的MoS2,并充当解决在阳极,回到原来的状态。
但是第一次尝试建立这样的电池是不成功的时充,锂离子不想回到一个平板的金属锂,并决定作为阳极的打击,导致生长的树(链的锂金属)、短路和防爆的电池。 这是随后阶段的详细研究的反应插入(嵌入的锂在有特殊晶体结构),允许替换的金属锂在碳:第一个焦炭和石墨,这是使用,直到现在还设有一个分层的结构,能够纳入锂离子。

锂离子电池阳极的锂金属(a)和阳极的层物质(b)。
开始使用碳材料为阳极,科学家们意识到,性质已经做了人类的伟大礼物。 石墨,当第一个充,形成一个保护层分解电解质的,称为SEI(固体电接口)。 的确切机制,其形成和组成仍未完全理解,但我们知道,没有这种独特的钝化层,电解质仍然分解,在阳极将被销毁,电池将来成年久失修。 因此,有第一工作阳极的基于碳材料,这是释放在组合物锂离子电池在90-当中。
同时,与修改阳极和阴极:事实证明,一个分层的结构是能够纳入锂离子,不仅硫和某些转型金属氧化物,如LiMO2(M=镍、钴、锰),这不仅是更为稳定的化学,但也允许创造细胞有更高的电压。 这LiCoO2被使用的阴极的第一个商业原型电池。

2. 新的反应,与时尚有关纳米材料:2000-2010年
在2000年,科学繁荣的纳米材料。 当然,进展纳米技术是不能幸免和锂离子电池。 并感谢他们,科学家们提出了绝对会似乎不适合这种技术材料,LiFePO4,一个领导人在使用电阴极电池。
但事情是,普通的,三个维颗粒Jelisaveta非常糟糕的开展离子和电子传导性非常低。 但是,由于一连串的nanostructuring是没有必要移动大距离,以适应进入纳米,因此插入一个更快和涂层的纳米薄碳膜提高了它的导电性。 导致销售不仅是少危险材料,不排放的氧气在较高的温度(如氧化物),而且还材料具有能力操作较高的电流。 因此,这种阴极材料制造商喜欢汽车的,尽管略低容量比LiCoO2。
同时,科学家寻找新的材料,进行交互与锂。 而且,事实证明,插入或嵌入的锂片是不是唯一的选择反应极中的锂离子电池。 例如,某些要素,即Si,Sn,Sb等, 形成一个"合金"锂当用在阳极。 有能力这一极为10倍的容量的石墨,但是有一个"但是":这样的一个电极的过程中形成的合金大大增加量,这会导致迅速裂和未来的成年久失修。 为了减少机械压力的极与这种增加,素(例如硅)建议使用的形式纳米粒子的封闭式中碳基体"吸收"变化中的体积。

但是变化的积不是唯一的问题的材料形成合金,并防止其广泛应用。 如上所述,石墨是形成"大自然的恩赐"-SEI。 和材料形成合金电解质分解地连续和增加抵抗极。 但尽管如此,周期性地在我们看到的消息说,一些电池中使用的"硅极"的。 是的,硅在使用它,但是在非常小的数量和混合与石墨的副作用是不太明显。 当然,当量的硅在阳极中只有百分之几,其余的石墨,显着增加的能力将不会的工作。
如果主题的阳极形式的合金,是现在发展中,一些研究,开始在过去十年中,很快来到了一个陷入瘫痪。 这适用,例如,所谓的转换反应。 在此反应中,一些化合物的金属(氧化物、氮化物、硫化物,等等)。 与锂,变成金属混合,用锂化合物:
MaXb==>:+bLinX
M:金属
X:O,N,C,S...
而且,正如你可以想象,与在这样的反应发生这样的变化,它甚至硅不是梦想。 例如,钴氧化变成钴金纳米粒子被包围在一个矩阵的氧化锂:

当然,这种反应不可逆转的相同之间的充电,并排放大电压差,使得这些材料没有用于应用程序。
有趣的是注意到,当这种反应是打开在科学期刊上开始公布的数百篇文章,关于这一主题。 但是然后hochetsja引用教授塔拉斯孔从法兰西学院,他说"反应转换是一个真实的实地实验研究材料的与nanoarchitectures给科学家的能力,使美丽的图像使用透射电子显微镜和出版着名的刊物,尽管绝对的实际无用这些材料。"
在一般情况下,总的来说,尽管事实上,在过去十年中,合成数以百计的新材料,用于电极的电池甚至使用几乎相同的材料为25年前。 为什么会发生?
3. 本挑战在于开发新的电池。
你可以看到在上述附记入历史的锂离子电池,没有一个字是说关于另一个,最重要的因素:电解质。 还有一个原因:电解质25年来几乎没有改变和工作的替代品的建议。 今天,在90-e年中,在形成的电解质的使用,锂盐(主要是LiPF6)的有机溶液中的碳酸盐(碳酸亚乙酯(EC)+二甲酯(DMC)项)。 但是因为电解质的进展,在增加的电池容量近年来有所放缓。
这里是一个例子:今天有材料的电极,这可能大大增加能力的锂离子电池。 这些包括,例如,LiNi0的。5Mn1的。5О4,这将使电池电压的单元在5伏。 但可惜的是,在压范围的电解质的基于碳变得不稳定。 或者另外一个例子:如上所述,今天使用了大量的硅(或其它形成金属合金,锂)在阳极,有必要解决的一个主要问题:形成为一个钝化层(SEI)这将防止连续分解电解质和破坏的电极,并为此我们需要发展一个根本的新组成的电解质。 但为什么这么难找到一个替代现有结构,之后,全的锂盐,和有机溶剂足够吗?!
和挑战构成了事实上的电解质应同时具备以下特点:
- 它需要的化学稳定的电池寿命,或者相反,它需要的抗氧化阴极和恢复阳极。 这意味着,试图增加的电力消耗量的电池,那就是,使用更多的氧化阴极,并减少了极的,不应导致分解电解质。
- 电解质必须具有良好的离子电导率和粘度低运输的锂离子在一个广泛的温度范围内。 到这个粘稠的碳酸亚乙酯加DMC自1994年以来。
- 锂盐应在有机溶剂中溶解的。
- 电解质应形成一个有效的钝化层。 碳酸亚乙酯是众所得到,而其他溶剂,如碳酸丙,这是最初的测试索尼破坏的结构的阳极的,因为它是埋在平行的锂。
在与改进现有的技术,科学家们正在使一个全新的解决方案。 这些决定可以降低到试图摆脱的液中的溶剂的基础上的碳酸盐。 这些技术包括,例如,离子液体。 离子液体基本上是熔盐与熔点非常低,他们中有些人甚至在室温下保持液体。 和所有的事实,因为这些特殊盐,位阻结构,该结构将会复杂化的结晶。

这似乎是一个伟大的想法完全消除的溶剂,其易燃性,并反应寄生反应的锂。 但事实上,消除溶剂造成的那一刻更多的问题比它解决的。 首先,在通常的电解质溶剂"牺牲自己"建立一个保护层,在电极上面。 作为部件的离子液体,与这个任务我还没有(阴离子,顺便说一句,还可以从事的寄生反应与电极,作为溶剂)。 其次,这是非常困难的选择离子液体用正确的阴离子,因为它们不仅影响的熔点盐而且还在化学稳定性。 唉,最稳定的阴离子,以盐的形式,熔在高温下,反之亦然。
另一种方法来摆脱该溶剂的基础上的碳酸盐-使用固体聚合物(例如聚酯)导锂,其中,首先,尽量减少风险的电解质泄漏出,并且会防止生长的树突时使用的金属锂在阳极。 但是,面临的主要问题的创造者聚合电解质是非常低的离子传导性,因为锂离子们难以移动在这样一种粘稠状的媒介。 当然,这大大限制了电源的蓄电池。 下粘度需要发芽的树突。

研究人员还研究的固体无机物质进行锂通过的缺陷的结晶,并尝试将它们应用在形成的电解质的锂离子电池。 这个系统乍一看是完美的:化学和化学稳定性、耐温度上升和机械力量。 但这些材料,再次非常低的离子电导率,并使用他们celesoobrazno仅在形成的薄膜。 此外,这种材料的最高温度。 最后,与一个坚实的电解质是非常困难的创造机械触点之间的电子和极(在该领域的液电解质不相等)。
4. 结论。
由于介绍的锂离子电池,试图增加他们的能力不会停止。 但在最近几年增加容量有所减缓,尽管数以百计的拟议的新材料的电极。 但事实是,大多数这些新材料"坐上架"等待,直到一个新的、适合电解质。 和开发新的电解质的-在我看来更复杂的任务于发展的新的电极,作为需要考虑的不仅是电化学性质,但也为其相互作用,与电极。 在一般情况下,阅读新闻,如"开发一个新的超级电极..."应该进行检查,例如电极与电解质,以及是否有针对这个极电解液是适合的原则。 出版
资料来源:geektimes.ru/post/282424/