1019
Reacciones químicas asombrosos
Seguramente habrá entre los lectores de este post son gente que adoraba en Química durante sus años escolares. En efecto: soplar bulbo escritorios de disolución y pintado de la cabeza a los pies era increíblemente divertido. Propongo, pues, a mirar las reacciones químicas más fascinantes de un gifok colección única. Siga leyendo!

Las reacciones químicas
1. "serpiente Faraón" - el colapso del tiocianato de mercurio

Quemar tiocianato de mercurio conduce a su descomposición en otras tres sustancias químicas. Estos tres productos químicos, a su vez descomponerse en tres sustancias, lo que conduce a un enorme despliegue de \ "serpiente \».
Partido
2. Burning
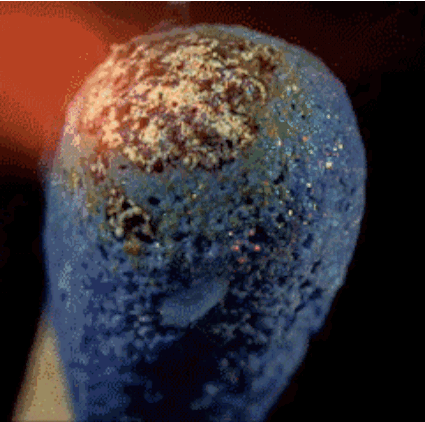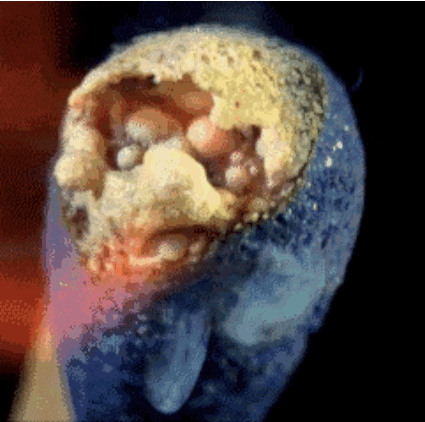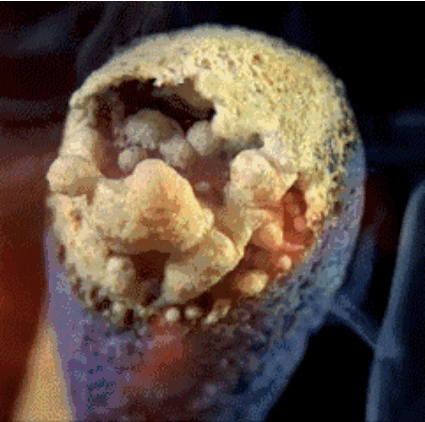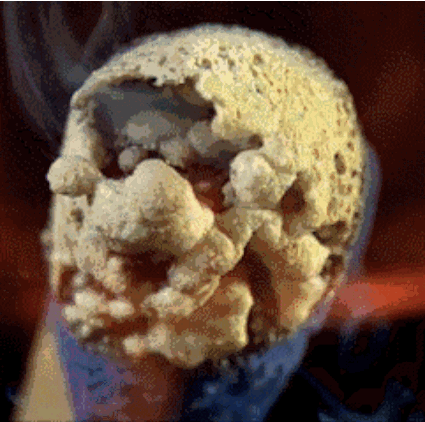
Cabeza Partido contiene fósforo rojo, azufre y sal clorato de potasio. El calor generado por la sal de fósforo y de potasio se descomponen durante clorato libera oxígeno. El oxígeno en combinación con azufre produce llamas cortas, que utilizamos a la luz, como una vela.
3. Fire +
hidrógeno

El gas hidrógeno es más ligero que el aire y puede encender una llama o chispa, que conduce a una dramática explosión. Es por eso que ahora se utiliza más comúnmente helio, en lugar de globos de llenado de hidrógeno.
4. Mercurio +
aluminio

El mercurio penetra en la capa protectora de óxido (óxido) de aluminio, haciendo que se corroe mucho más rápido.
[color = # 3333FF] Ejemplos de reacciones químicas [/ color]
5. serpiente veneno +
sangre

Una gota de veneno de víbora que se mete en una placa de Petri con la sangre, hace que ella acurrucarse en una mata espesa sólido. Esto es lo que sucede en nuestro cuerpo cuando estamos mordido por una serpiente venenosa.
6. solución de sulfato de cobre Plancha +
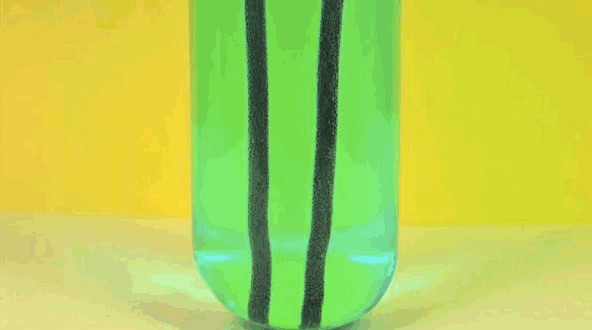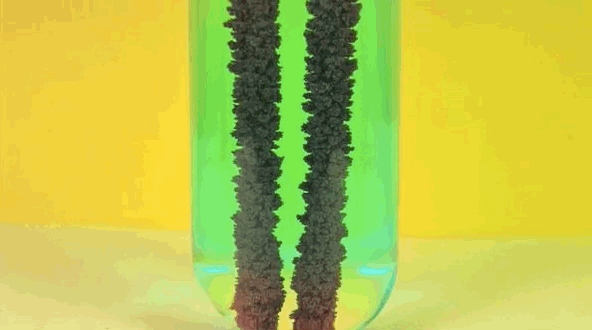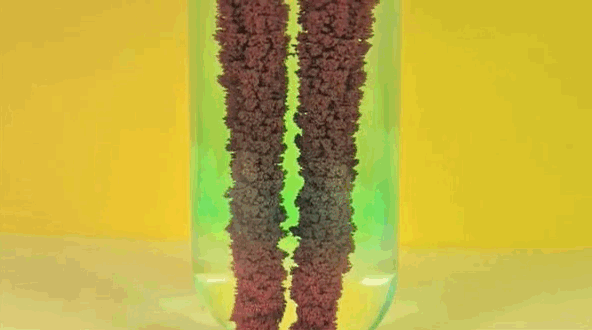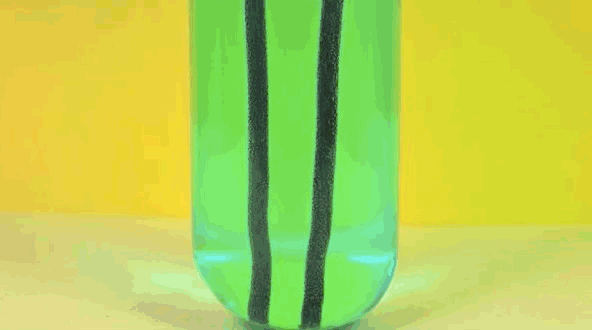
Hierro reemplaza el cobre en solución, lo que hace de piedra azul en el vitriolo. El cobre puro está pasando hierro.
7. encendido botella de gas

8. tabletas de Cloro + alcohol en una botella cerrada

La reacción conduce a un aumento de la presión y de la ruptura de los extremos de contenedores.
9. La polimerización de
p-nitroanilina

En SFII a media cucharadita de p-nitroanilina o 4-nitroanilina se añaden varias gotas de ácido sulfúrico concentrado.
10. Sangre peróxido de hidrógeno

La enzima en la sangre, llamada catalasa convierte peróxido de hidrógeno en agua y gas oxígeno, burbujas de oxígeno crean espuma.
Experimentos químicos
11. galio en
agua caliente

Galio, que se utiliza principalmente en la electrónica, tiene un punto de fusión de 29, 4 grados centígrados, y por lo tanto se fundirá en sus manos.
12. La transición lenta
modificación beta-tin alfa

En temperaturas frías beta alótropo del estaño (plata, metálico) espontáneamente entra en alótropo alfa (polvo gris).
13. sodio poliacrilato +
agua

Poliacrilato de sodio - el mismo material que se utiliza en pañales para bebés, actúa como una esponja, absorbiendo la humedad. Cuando se mezcla con agua, el compuesto se convierte en un gel sólido mientras que el agua ya no es líquido y no se puede verter.
Gas 14. 220 radón se inyecta en la cámara de niebla

Las huellas de las causa de dos partículas alfa producirse en forma de V (núcleos de helio-4), que se liberan cuando el radón se desintegra en el polonio y plomo.
Experimentos de química doméstica
15. Las perlas de hidrogel y
agua multicolor

En este caso, el efecto de difusión. Un hidrogel es un perlas de polímero que absorben agua muy bien.
16. La acetona
+ espuma

Espuma consiste en poliestireno, que cuando se disuelve en acetona, libera el aire en la espuma, lo que crea una mirada como si usted disuelve una gran cantidad de material en una pequeña cantidad de líquido.
17. hielo + lavavajillas
detergente seco

El hielo seco se coloca en el agua crea una nube, y detergente para lavavajillas en el agua mantiene el dióxido de carbono y vapor de agua en la forma de una burbuja.
18. Una gota de detergente añadido a la leche con
colorante de alimentos

Leche - es principalmente agua, pero también contiene vitaminas, minerales, proteínas y pequeñas gotas de grasa que se encuentran suspendidas en la solución
.
Detergente para lavavajillas debilitan los enlaces químicos que mantienen las proteínas y las grasas en la solución. Las moléculas de grasa confuso para los que comienzan moléculas de jabón que se apresuran a conectar con las moléculas de grasa, mientras que la solución se mezcla de manera uniforme.
19. \ "Elefante Pasta de dientes \»

Levadura y agua caliente se vierte en el recipiente con detergente, peróxido de hidrógeno y colorante de alimentos. La levadura es un catalizador para la liberación de oxígeno de peróxido de hidrógeno, creando una gran cantidad de burbujas. El resultado es una reacción exotérmica, con la formación de espuma y de liberación de calor.
20. Un
bombilla fundida

El filamento de tungsteno se rompe, causando un circuito eléctrico corto circuito que hace que el filamento a brillar.
21. ferrofluido en un frasco de vidrio

Fluido ferromagnético - es un líquido que está fuertemente magnetizado en un campo magnético. Se utiliza en unidades de disco duro, y en la ingeniería.

Más ferrofluido.
22. El yodo +
aluminio

La oxidación de aluminio finamente dividido se produce en el agua para formar un par de color púrpura oscuro.
23. Rubidio +
agua

Rubidio reacciona rápidamente con agua, formando un hidróxido de rubidio y gas hidrógeno. La reacción es tan rápido que si se lleva a cabo en un recipiente de vidrio, que puede romperse.

Las reacciones químicas
1. "serpiente Faraón" - el colapso del tiocianato de mercurio

Quemar tiocianato de mercurio conduce a su descomposición en otras tres sustancias químicas. Estos tres productos químicos, a su vez descomponerse en tres sustancias, lo que conduce a un enorme despliegue de \ "serpiente \».
Partido
2. Burning

Cabeza Partido contiene fósforo rojo, azufre y sal clorato de potasio. El calor generado por la sal de fósforo y de potasio se descomponen durante clorato libera oxígeno. El oxígeno en combinación con azufre produce llamas cortas, que utilizamos a la luz, como una vela.
3. Fire +
hidrógeno

El gas hidrógeno es más ligero que el aire y puede encender una llama o chispa, que conduce a una dramática explosión. Es por eso que ahora se utiliza más comúnmente helio, en lugar de globos de llenado de hidrógeno.
4. Mercurio +
aluminio

El mercurio penetra en la capa protectora de óxido (óxido) de aluminio, haciendo que se corroe mucho más rápido.
[color = # 3333FF] Ejemplos de reacciones químicas [/ color]
5. serpiente veneno +
sangre

Una gota de veneno de víbora que se mete en una placa de Petri con la sangre, hace que ella acurrucarse en una mata espesa sólido. Esto es lo que sucede en nuestro cuerpo cuando estamos mordido por una serpiente venenosa.
6. solución de sulfato de cobre Plancha +
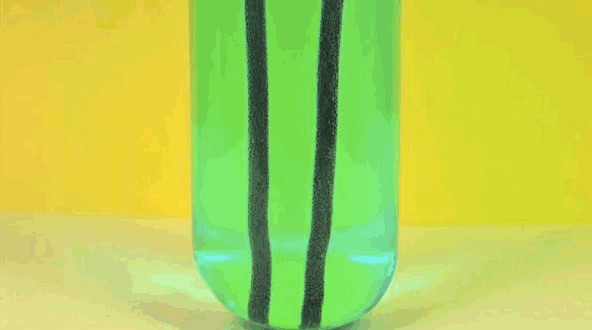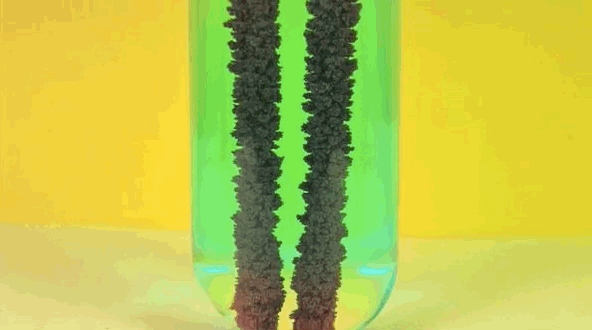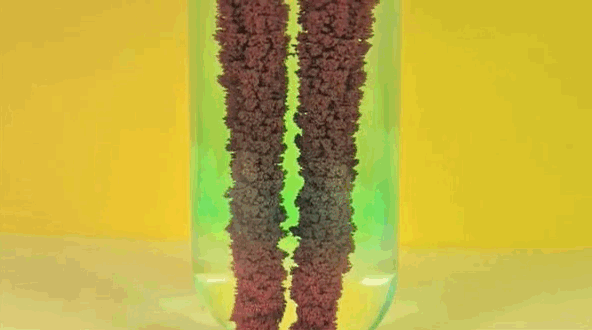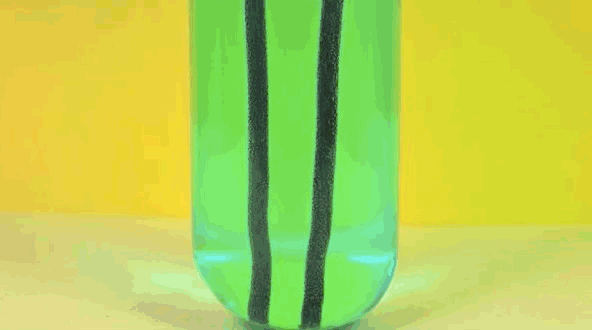
Hierro reemplaza el cobre en solución, lo que hace de piedra azul en el vitriolo. El cobre puro está pasando hierro.
7. encendido botella de gas

8. tabletas de Cloro + alcohol en una botella cerrada

La reacción conduce a un aumento de la presión y de la ruptura de los extremos de contenedores.
9. La polimerización de
p-nitroanilina

En SFII a media cucharadita de p-nitroanilina o 4-nitroanilina se añaden varias gotas de ácido sulfúrico concentrado.
10. Sangre peróxido de hidrógeno

La enzima en la sangre, llamada catalasa convierte peróxido de hidrógeno en agua y gas oxígeno, burbujas de oxígeno crean espuma.
Experimentos químicos
11. galio en
agua caliente

Galio, que se utiliza principalmente en la electrónica, tiene un punto de fusión de 29, 4 grados centígrados, y por lo tanto se fundirá en sus manos.
12. La transición lenta
modificación beta-tin alfa

En temperaturas frías beta alótropo del estaño (plata, metálico) espontáneamente entra en alótropo alfa (polvo gris).
13. sodio poliacrilato +
agua

Poliacrilato de sodio - el mismo material que se utiliza en pañales para bebés, actúa como una esponja, absorbiendo la humedad. Cuando se mezcla con agua, el compuesto se convierte en un gel sólido mientras que el agua ya no es líquido y no se puede verter.
Gas 14. 220 radón se inyecta en la cámara de niebla

Las huellas de las causa de dos partículas alfa producirse en forma de V (núcleos de helio-4), que se liberan cuando el radón se desintegra en el polonio y plomo.
Experimentos de química doméstica
15. Las perlas de hidrogel y
agua multicolor

En este caso, el efecto de difusión. Un hidrogel es un perlas de polímero que absorben agua muy bien.
16. La acetona
+ espuma

Espuma consiste en poliestireno, que cuando se disuelve en acetona, libera el aire en la espuma, lo que crea una mirada como si usted disuelve una gran cantidad de material en una pequeña cantidad de líquido.
17. hielo + lavavajillas
detergente seco

El hielo seco se coloca en el agua crea una nube, y detergente para lavavajillas en el agua mantiene el dióxido de carbono y vapor de agua en la forma de una burbuja.
18. Una gota de detergente añadido a la leche con
colorante de alimentos

Leche - es principalmente agua, pero también contiene vitaminas, minerales, proteínas y pequeñas gotas de grasa que se encuentran suspendidas en la solución
.
Detergente para lavavajillas debilitan los enlaces químicos que mantienen las proteínas y las grasas en la solución. Las moléculas de grasa confuso para los que comienzan moléculas de jabón que se apresuran a conectar con las moléculas de grasa, mientras que la solución se mezcla de manera uniforme.
19. \ "Elefante Pasta de dientes \»

Levadura y agua caliente se vierte en el recipiente con detergente, peróxido de hidrógeno y colorante de alimentos. La levadura es un catalizador para la liberación de oxígeno de peróxido de hidrógeno, creando una gran cantidad de burbujas. El resultado es una reacción exotérmica, con la formación de espuma y de liberación de calor.
20. Un
bombilla fundida

El filamento de tungsteno se rompe, causando un circuito eléctrico corto circuito que hace que el filamento a brillar.
21. ferrofluido en un frasco de vidrio

Fluido ferromagnético - es un líquido que está fuertemente magnetizado en un campo magnético. Se utiliza en unidades de disco duro, y en la ingeniería.

Más ferrofluido.
22. El yodo +
aluminio

La oxidación de aluminio finamente dividido se produce en el agua para formar un par de color púrpura oscuro.
23. Rubidio +
agua

Rubidio reacciona rápidamente con agua, formando un hidróxido de rubidio y gas hidrógeno. La reacción es tan rápido que si se lleva a cabo en un recipiente de vidrio, que puede romperse.