822
Станфорд вдосконалив дешевий метод електролізу води
 Р
РУ серпні минулого року вчені зі Стенфордського університету вперше продемонстрували недорогий шлях до електролізної води, тобто для відокремлення H2O в кисневе та водневе. Простий акумулятор AAA достатньо для ініціювання хімічного процесу. Звичайно, замість акумулятора можна використовувати невелику сонячну панель, яка забезпечує потенційну різницю не менше 1,5 вольт.
Минулого року вчені використовували катавіди та аноди з оксиду нікелю та нікелю. Це перший досвід у світі, коли електроліз вдалося відмовитися від електродів дорогоцінних металів (плонінум, іридіум) і коли процес був на такій низькій напруги.
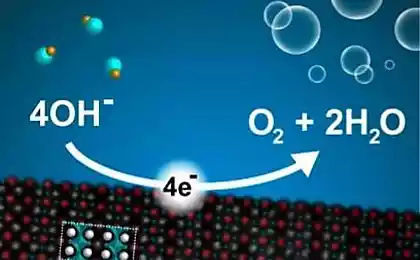
Тепер вони зуміли зробити електроліз дешевше і простіше, що зробить водне паливо ще дешевше, якщо технологія доведена до промислового рівня. Удосконалений процес використовує той же каталізатор з NiFeOx для катоду та аноду. Тобто анод і катод більше не вимагають різного фактора pH (один кислотний, інший лужний), тому їх легко і зручно поміщаються в загальний посуд з водою. Залишилося тільки зібрати вивільнений киснем і воднем (хоча краще не збирати киснем, але відразу ж звільнити в атмосферу).
Відео нижче показує, як працює електроліз від батареї AAA. Кисень випускають з одного електрода і водню з іншого. Авторами наукового стану праці, що інтенсивність реакції ще вище, ніж при об'єднанні електродів із традиційного оксиду ітрію та платинуму.
Реакція стабільна і дуже активний по всій поверхні електродів.
Секрет фокусу лежить в структурі каталізатора NiFeOx. Хоча це прості матеріали, структура матеріалу дуже специфічна. Це якось «поросити» на вуглецевих нанофібриках (це не зовсім зрозуміло з наукової роботи, як це зробити). Вчені говорять, що цей чудовий каталізатор в майбутньому може бути адаптований для хімічних реакцій, крім електролізу води.
Незважаючи на те, що ця технологія виглядає досить бездоганною, і всі вісім співавторів наукової роботи є китайці, не варто забувати, що вони працюють в кафедрі матеріалів і технологій в Stanford University, один з найбільш авторитетних наукових установ світу.
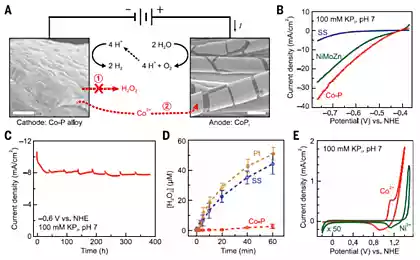
В результаті каталітичної реакції, наночастинок оксиду металів (ірон, кобальт, оксиди нікелю або суміші їх оксидів) близько 20 нм в розмірах електрохімічно перетворюються в наночастинок ультра-малих наночастинок азоту з діаметром 2-5 нм в результаті літій-індукованої реакції. На відміну від традиційного хімічного синтезу цей метод дозволяє підтримувати відмінне електричне з'єднання між наночастиками і призводить до утворення великих площ для каталітичної реакції.
Експеримент протестував безперервну роботу пристрою таким чином на цілий тиждень (більше 200 годин) без деградації електродів, говорить Yi Cui, один з авторів дослідження. Додайте, що ефективність електролізу води становить 82% при кімнатній температурі (приблизно при нормальному тиску теж).
Опубліковано 23 червня 2015 року в журналі Nature Communications (безкоштовний доступ).
Як зауважив рік раніше, це дуже важливий проект, оскільки він значно спрощує технологію виробництва водневих паливних елементів. На таких клітинах можуть працювати мобільні електронні та авто.

Toyota Mirai, один з перших водневих транспортних засобів. Продажі розпочалися 15.12.2014. Під дном має два циліндри водню при тиску 70 МПа. Заправка займає 3-5 хвилин. Діапазон: 480 км
Важливо, коли водень спалюється, єдиний продукт горіння є водою. Так само вода, яка розщеплюється на компоненти, наприклад, сонячне світло в першому етапі технічного процесу.
Джерело: geektimes.ru/post/252516/
Fallout вентилятор отримує Fallout 4 гра від Bethesda для його пляшки шапки
Інвестиції Тренди: Робототехніка