499
0,2
2016-11-10
Ключ к пониманию инсулинорезистентности
Тема инсулинорезистентности является очень острой. Большинство болезней цивилизации, начиная от депрессии, сердечно-сосудистых болезней до болезни Альцгеймера связана с обменными нарушениями. Однако весьма интересно, какая связь существует между образом жизни и болезнями, как нутриенты вызывают конкретные нарушения обмена веществ.
Поэтому сегодня я расскажу про СЖК – свободные жирные кислоты (на иллюстрациях обозначены как FFA – free fatty acids). С одной стороны СЖК – это главный источник энергии, но с другой стороны – это и важная сигнальная молекула.
Особо хочу отметить, что когда речь идет о хроническом повышении СЖК как причине инсулинорезистентности (ИР), то помните, что проблема не в СЖК, а в том, что им некуда использоваться, поэтому в крови появляется их избыток. Статья получилась большой, но кому интересно понять логику здоровья и болезни – то добро пожаловать.
Свободные жирные кислоты: ключ к пониманию инсулинорезистентности
Свободные жирные кислоты.
Свободные (или не этерифицированные) жирные кислоты (СЖК) образуются в результате гидролиза триглицеридов, содержащихся в жировых тканях. Плазменные жирные кислоты или этерифицированы и в этом случае большей частью связаны с альбумином или не этерифицированы и находятся в свободном состоянии. Свободные жирные кислоты (СЖК) входят в состав липопротеинов 5-го класса.
Последние состоят из длинноцепочечных жирных кислот, прочно связанных с двумя специфическими участками молекулы альбумина; при повышении уровня СЖК в плазме они занимают дополнительные участки этой молекулы, но связь в данном случае оказывается менее прочной.
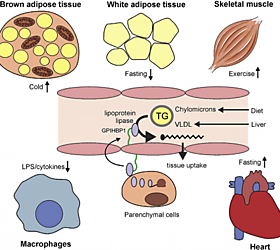
СЖК представляют собой, главный энергетический субстрат организма. Они образуются в процессе липолиза триглицеридов, накопленных в клетках жировой ткани. Тканевая липаза в этих клетках находится под нейроэндокринным контролем, и ее активация осуществляется через аденилатциклазную систему.
Вторым источником СЖК плазмы служит гидролиз триглицеридов, содержащихся в липопротеинах, под влиянием липопротеиновой липазы. Способность скелетных мышц (и других тканей) подстраивать свой метаболизм к доминирующему в данный момент субстрату принято называть «хорошим метаболическим здоровьем» или «метаболической гибкостью». Понятно, что хорошее «метаболическое здоровье» связано с нормальной чувствительностью к инсулину.
Обмен свободных жирных кислот.
Период полужизни СЖК весьма непродолжителен — 4 — 8 мин, и они легко поглощаются из плазмы мышечными клетками организма. Второй путь их обмена заключается в поглощении печенью и ресинтезе в триглицериды, которые затем могут транспортироваться из печени в составе ЛПОНП или окисляться до ацетил-СоА. В физиологических условиях уровень СЖК в крови может повышаться и снижаться очень быстро, удовлетворяя потребность организма в этой форме энергии.
Их содержание обычно ниже после всасывания углеводов и возникающего вследствие этого выброса инсулина, но по мере снижения уровня глюкозы в крови после еды их уровень повышается. Натощак в крови содержится, как правило, 400 — 600 мкэкв/л СЖК; при более длительном голодании (до 24 — 72 ч) уровень СЖК может достигать 1000 — 1500 мкэкв/л. Глюкагон, адреналин, гормон роста и АКТГ также повышают уровень СЖК. Главными физиологическими регуляторами содержания СЖК в плазме служат инсулин и адреналин.
Каждую минуту утилизируется 20-40% СЖК, попадающих в плазму, — они окисляются, реэтерифицируются или превращаются в другие жирные кислоты. Во время покоя окисление происходит, в основном, в печени и в сердце, а при нагрузках — в скелетных мышцах, причем в последнем случае доля окисляющихся СЖК, возрастает приблизительно от 20 до 60%.
Большинство СЖК, захваченных клетками печени, реэтерифицируется с образованием главным образом триглицеридов, а также фосфолипидов, для синтеза которых используется, как правило, линолевая кислота. В плазме СЖК обнаруживаются в диапазоне концентраций от 100 мкмоль/л до 1 ммоль/л и их уровень сильно зависит от времени суток.
После каждого приема пищи уровень СЖК в плазме падает, так как инсулин подавляет в жировых клетках липолиз, в результате которого и образуются СЖК. В ночное время концентрация СЖК в плазме возрастает. К этим нормальным суточным колебаниям уровней СЖК «подстраиваются» почти все другие ткани, в частности, скелетные мышцы, которые «переключаются» с утилизации глюкозы (днем) на потребление СЖК (ночью).
Некоторые причины нарушения обмена СЖК.
Ключевое нарушение обмена свободных жирных кислот – это их хроническое повышение. Хроническое повешение уровня СЖК может быть вызвано множеством причин пищевого и стрессового типа. Например, избыток углеводов, при котором начинается синтез новых жирных кислоты из избытка углеводов.
Поскольку у здорового человека 75-80% глюкозы утилизируется скелетной мускулатурой, то физическая активность рабочих тяжелого труда может предотвратить развитие «функциональной» резистентности к инсулину. Недостаток физической активности также вызывает повышение СЖК.
Хронический стресс любого типа – это еще одна причина хронического повышения СЖК. Во время стресса в крови повышается уровень СЖК для обеспечения работы сердца и мышц. Но человек обычно не двигается и все эти жирные кислоты циркулируют в крови длительное время.
В широкомасштабных исследованиях обнаружена обратная зависимость между положением человека на социально-экономической лестнице и вероятностью развития метаболического синдрома. Делается вывод, что развитие метаболического синдрома – биологический механизм, приводящий к «социальному неравенству в распределении коронарного риска среди людей».
Высокие коронарные риски (повышенный уровень триглицеридов и низкий уровень холестерина-липопротеидов высокой плотности) связаны с низким социально-экономическим статусом («бедным детством»), что в зрелые годы приводит к избыточному весу и ожирению.
Кроме того, психологические стрессы также способствуют развитию СД1 и СД2, так как высокий уровень СЖК связан с повышенным образованием в митохондриях активных форм кислорода (оксидативный стресс), что в конечном итоге ведет к снижению способности клеток адекватно реагировать на действие инсулина.
СЖК – и метаболит, и сигнальная молекула.
Многочисленные исследования последних лет показали, что, во-первых, СЖК – это не только высокоэнергетическое топливо, но и важные сигнальные молекулы. Их концентрация – важный регуляторный фактор, влияющий на интенсивность утилизации глюкозы в мышцах.
И, второе, адипозные ткани – это еще и важнейший эндокринный орган, который секретирует большое количество факторов, названных адипоцитокинами, которые имеют или сенсибилизирующее влияние на инсулин (это адипонектин и лептин), в частности, фактора некроза опухолей – альфа (ФНО- альфа), резистин и др.
При избыточном количестве адипозных тканей происходит их избыточный липолиз. В норме высвобождение СЖК из адипозных тканей строго регулируется, что обеспечивает другие ткани четко сбалансированным количеством СЖК, необходимым для адекватного удовлетворения их энергетических нужд.
Но при ожирении в кровоток поступают, таким образом, патологически повышенные количества сигнальных молекул (в особенности, ФНО-альфа), что ведет к нарушению метаболического гомеостаза. Таким образом, самые ранние события, приводящие к нарушению механизма действия инсулина и возникновение ИР, происходят именно в адипозных клетках и задолго до возникновения нарушенной толерантности к глюкозе.
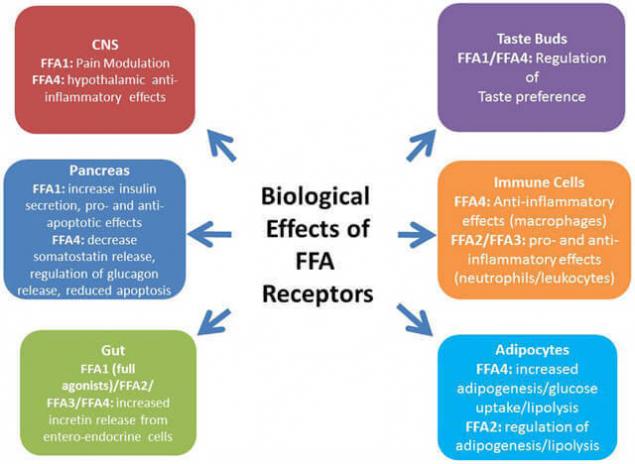
Профиль свободных жирных кислот в сыворотке меняется в зависимости от пола и возраста, режима питания, изменения гормонального статуса; например, адреналэктомия или кастрация приводят к изменению профиля ЖК.
Изменение концентрации свободных ЖК в свою очередь приводит к значительным изменениям на двух стадиях переноса гормональной информации: связывания глюкокортикоидов с их специфическими белками-носителями в плазме и с тканевыми рецепторами.
С современных позиций свободные жирные кислоты более не рассматриваются как пассивные субстраты, вовлеченные в метаболические процессы. Свободные жирные кислоты – это важные метаболические сигналы и участники липидных нарушений. В ряде ситуаций они ведут себя как гормоноподобные молекулы, влияя на транскрипцию генов, связываясь с рядом рецепторов.
Среди рецепторов, которые связываются со СЖК/FFA или их дериватами, особое место занимают пероксисом пролифератор-активированные рецепторы – PPARs. Также сопряжённый с G-белком рецептор GPR120, который в большом количестве экспрессируется в кишечнике, функционирует как рецептор для ненасыщенных длинноцепочечных свободных жирных кислот FFA. Стимуляция GPR120 свободными жирными кислотами способствует секреции GLP-1 и повышает количество циркулирующего инсулина.
Свободные жирные кислоты и здоровье.
В зарубежной медицинской литературе свободные жирные кислоты (СЖК) или неэстерифицированные жирные кислоты, которые образуются в результате гидролиза три-глицеридов, содержащихся в адипозных тканях, называют «красной лампочкой на приборной доске миокарда».
Повышение их плазменных уровней сигнализирует о возрастающей опасности: вначале о метаболическом синдроме, потом об инсулинорезистентности, диабетической кардиомиопатии, а далее – ишемической болезни сердца. Далее эта лампочка может перегореть, и вспыхнут «лампочки» маркеров некроза миокарда, свидетельствующие, что «точка невозврата» пройдена.
Таким образом, повышенные уровни СЖК прямым образом связаны с ожирением, т.е. «эти лампочки начинают светиться задолго до развития конечной точки», что делает возможным эффективное проведение корригирующих мероприятий.
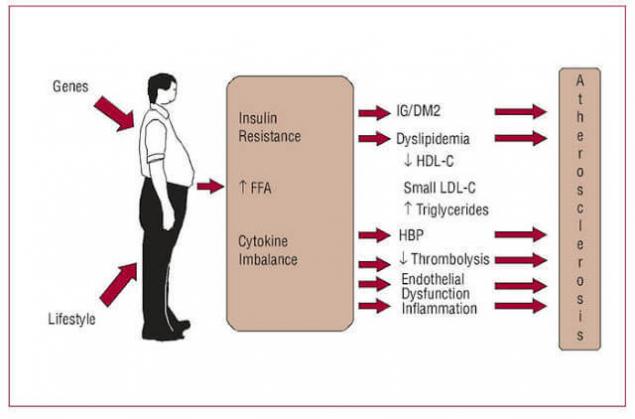
Многочисленные результаты недавних исследований четко указывают: повышенные уровни СЖК, вызванные избыточным количеством жировой ткани – если не первая, то, по крайней мере, одна из главных причин возникновения ИР. Многократно и достоверно показано, что большинство пациентов, страдающих ожирением, метаболическим синдромом и сахарным диабетом второго типа (СД 2), имеют повышенные уровни СЖК, что приводит к ИР многих тканей – жировой, мышечных, печени, а также эндотелиальных клеток.
СЖК – независимый предиктор нарушения толерантности к глюкозе и СД 2. Итак, повышенный поток СЖК из большой массы адипозных клеток, а также нарушения в механизмах, хранения триглицеридов и в механизмах липолиза в тканях, исходно нормально чувствительных к инсулину – это, похоже, самые ранние проявления аномалий, приводящих к ИР.
Принципиально, что эти нарушения обнаруживаются еще до развития постпрандиальной гипергликемии или до развития гипергликемии натощак. Действительно, повышение натощак плазменных уровней СЖК, пожалуй, самое ранее указание на будущее нарушение толерантности к глюкозе.
Лестница исулинорезистентности.
Шаг первый: нарушение лептиновой регуляции (лептинорезистентность).
В распределении жирных кислот в организме человека участвуют преимущественно два гормона: гормон роста, который контролирует мобилизацию жирных кислот из жировой ткани, и лептин, который контролирует β-окисление жирных кислот в митохондриях.
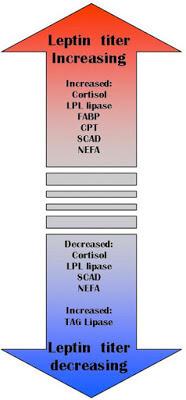
Одна из важных функций лептина – это удержание триглицеридов в адипоцитах. Нормальный уровень лептина защищает прочие органы от накопления жира (сосуды, печень, мышцы и др.). Лептин активирует карнитин-пальмитоил-трансфера зу-1, которая связывает жирную кислоту с карнитином, а последний переносит ее через мембрану митохондрий, и этот процесс строго регулируется. Лептин также стимулирует окисление жирных кислот и уменьшает количество триацилглицеровлов в мышечной ткани. Также установлено, что лептин подавляет активность ацетил-КоА-карбоксилазы!
Хронические стрессы, переедание, недоедание, избыток сахара, гиподинамия приводят к нарушению работы лептиновой системы. Если возникает резистентность к лептину, то это приводит к увеличению количества свободных жирных кислот. Наступает второй шаг – хроническое повышение СЖК.
Шаг второй: увеличение висцеральной жировой ткани.
Именно висцеральная жировая ткань будет мощнейшим источником СЖК. Висцеральный жир увеличивается пропорционально индексу массы тела и является независимым предиктором развития сахарного диабета 2 типа. Висцеральная жировая ткань – это основной источник свободных жирных кислот (СЖК).
При висцеральном ожирении в печень через систему воротной вены поступает чрезмерное (в 20-30 раз превышающее норму) количество свободных жирных кислот, что подвергает печень серьёзным перегрузкам и, в итоге, приводит к развитию указанных выше метаболических нарушений.
Висцеральный жир, присутствующий вокруг внутренних органов, брыжейке и сальнике, отличается от подкожного по типу адипоцитов, их эндокринной функции, липолитической активности, чувствительности к инсулину и другим гормонам.
В отличие от подкожной жировой ткани, венозная кровь, оттекающая от висцерального жира, через портальную систему напрямую поступает в печень. Это обусловливает непосредственное поступление в печень большого количества свободных жирных кислот (СЖК) и адипокинов, синтезирую- щихся в висцеральной жировой ткани.
Адипокины, в свою очередь, активируют печеночные иммунные механизмы, ведущие к образованию провоспалительных медиаторов, таких как С-реактивный белок (СРБ) и другие. Свободные жирные кислоты, в большом количестве поступающие в печень из висцеральной жировой ткани, обусловливают развитие печеночной инсулинорезистентности.
Секретируя моноцитарный хемоаттрактантный протеин-1 (MCP-1), способствующий макрофагальной инфильтрации жировой ткани, адипоциты обусловливают провоспалительное состояние.
Макрофаги, в свою очередь, представляют собой важный источник провоспалительных цитокинов, таких как фактор некроза опухолей-α (ФНО-α) и интерлейкин-6 (ИЛ-6). Висцеральная жировая ткань отличается большей инфильтрацией воспали- тельными клетками, и поэтому секретирует большие количества провоспалительных цитокинов по сравнению с подкожным жиром
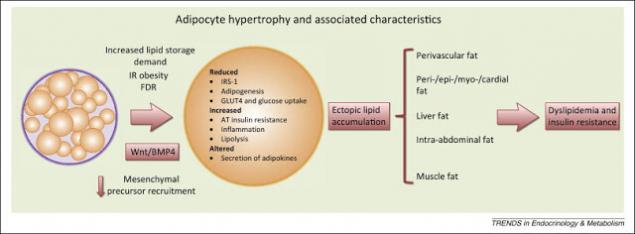
Эктопический жир - т.е. жир, которые находится не в подкожно-жировой клетчатке. Этот жир чаще всего висцеральный, или печеночный, или межмышечный. Но его объединяет то, что это не подкожный жир, а находящийся с «неправильном» месте. Дальнейшее развитие болезни будет зависеть от того, в каких именно тканях, не предназначенных для их хранения, будут накапливаться СЖК. Если они накапливаются в скелетных мышцах – это приведет к ИР, если в печени – к дислипидемии. Сначала, как правило, развивается ИР, потом, с ее утяжелением – ишемическая болезнь сердца – ИБС.
Шаг третий: хроническое повышение СЖК.
Как было показано выше, при висцеральном ожирении в печень через систему воротной вены поступает чрезмерное (в 20-30 раз превышающее норму) количество свободных жирных кислот, что подвергает печень серьёзным перегрузкам и, в итоге, приводит к развитию указанных выше метаболических нарушений. В крови появляется хронический повышенный уровень СЖК. Вместе с лептинорезистентностью это постепенно приводит к увеличению количества жира в нежировых органах.
Под действием СЖК в жировой ткани образуются более крупные адипоциты, резистентные к действию инсулина, инициируется процесс местного воспаления, увеличивается секреция провоспалительных цитокинов.
Хроническое повышение уровня жирных кислот в крови является следствием нарушения в организме системы регулирования их гомеостаза. Резистентность к лептину, по-видимому, не допускает превышения некого его стационарного предела окисления и, следовательно, утилизации избыточного количества жирных кислот в митохондриях.
Поэтому, как можно предположить, возникает ситуация, когда, вследствие повышенного содержания жирных кислот в околоклеточном пространстве, их поток в клетку усиливается (из-за повышения содержания жирных кислот в организме ввиду их недорасходования), а при одновременной резистентности к лептину окисление жирных кислот остается на прежнем уровне.
Возможно, обратная связь между поступлением жирных кислот в клетку нежировой ткани и их секрецией в кровь либо нарушается, либо она вообще не существует, т.е. отсутствует механизм поддержания стационарного уровня жирных кислот в крови. Если такое предположение верно, то в этом отношении регуляция метаболизма жирных кислот принципиально отличается от регуляции обмена глюкозы, стационарный уровень которой поддерживается системой гормонов.
Под контролем находится, вероятно, только окисление жирных кислот в митохондриях, т.е. внутриклеточная утилизация этого энергетического субстрата. В последние годы исследуются механизмы регуляции потока жирных кислот в организме.
Было открыто семейство ядерных рецепторов PPAR, они стали известны в связи со способностью индуцировать пролиферацию пероксисом и канцерогенез в печени в ответ на воздействие ксенобиотиков. Открыты три изоформы PPAR— α, γ и δ, и наиболее изучены свойства рецеп торов PPARα и PPARγ. Лигандами для рецепторов служат насыщенные, ненасыщенные и мононенасыщенные жирные кислоты.
PPARγ экспрессируется в адипоцитах и снижает секрецию жирных кислот в кровь из жировой ткани. PPARα экспрессируется в клетках печени, скелетной и сердечной мышц и действует как «липостат», регулируя процессы внутриклеточного синтеза и β-окисления жирных кислот в митохондриях и пероксисомах.
PPAR стимулируются лептином, гормоном роста и инсулином, их экспрессия подчиняется циркадному ритму, они экспрессируются в ответ на прием пищи. Эти рецепторы осуществляют внутриклеточную регуляцию жирных кислот, поддерживая стационарный уровень потребления энергии клеткой, но они, по-видимому, все-таки не участвуют в поддержании гомеостаза жирных кислот на уровне организма.
Шаг четвертый: возникновение инсулирезистентности.
Повышенный уровень СЖК приводит к накоплению их в клетках, перестройке клеточных мембран и снижению инсулинорезистентности. Избыток триглицеридов в клетках вызывает увеличение синтеза воспалительных цитокинов. Именно жировые ткани в данный момент рассматриваются как место первоначального возникновения и развития ИР. Это происходит из-за: а) поступления в кровоток повышенных уровней СЖК и, 2) повышенной секреции адипоцитокинов.
Большая масса адипоцитов синтезирует повышенные количества провоспалительных цитокинов, что приводит к хроническому воспалительному процессу, который: а) нарушает путь передачи инсулинового сигнала и, б) повреждает функции митохондрий, что нарушает гомеостаз глюкозы. В частности, секретируемые жировыми клетками ИЛ-6 и ФНО-альфа утяжеляют ИР, а секретируемый ангиотензин II, повышает артериальное давление и способствует развитию атеросклероза.
Нарушение приспособительного механизма.
В клетке из жирных кислот, не израсходованных на β-окисление, сначала синтезируются фосфолипиды, а затем триглицериды, которые аккумулируются в цитоплазме. Внутриклеточные триглицериды в нежировых тканях содержат преимущественно пальмитиновую кислоту. Из пальмитиновой кислоты синтезируется сфингомиелин, который является основным компонентом мембранных рафтов, участвующих в регуляции активности мембранных рецепторов.
Синтез сфингомиелина, зависящий от содержания в клетке пальмитино вой кислоты, осуществляется по пути «пальмитиновая кислота → церамид → сфингомиелин». Именно путь синтеза церамида из пальмитиновой кислоты приводит к оксидативному апоптозу. Церамид является индуктором апоптоза как по окислительному пути (церамид блокирует комплекс III ЭТЦ, вызывая усиленную генерацию оксидантов), так и без вовлечения митохондрий.
Накопление триглицеридов в кардиомиоцитах ассоциировано со снижением синтеза кардиолипина и изменением дыхательной функции митохондрий, так как цитохром с оксидаза комплекса IV ЭТС связана с кардиолипином. Изменение структуры мембраны митохондрий приводит к высвобождению цитохрома с и к апоптозу без участия оксидантов. Таким образом, аккумуляция пальмитиновой кислоты в клетках нежировых тканей ведет к повышению синтеза церамида и снижению синтеза кардиолипина, что индуцирует апоптоз, и к изменению активности рецепторов.
В связи с этим аккумуляцию в клетках триглицеридов (сами триглицериды не индуцируют апоптоз) рассматривают как попытку организма избежать эффекта липотоксичности.
Сфингомиелин и пальмитиновая кислота проявляют высокую аффинность к холестерину. Увеличением содержания сфингомиелина и пальмитиновой кислоты в мембране можно объяснить ассоциированное с возрастом накопление в мембранах холестерина, а также изменение чувствительности инсулинового рецептора.
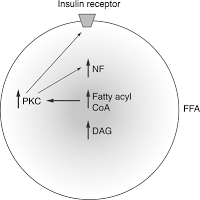
Инсулиновый рецептор связан с мембранными рафтами, и изменение состава рафтов влияет на его чувствительность. Аккумуляция триглицеридов в нежировых тканях и сопряженное с этим снижение чувствительности инсулинового рецептора ведет к возникновению резистентности к инсулину и гипергликимии, т.е. к повышенному содержанию глюкозы в крови. Рецептор к инсулину представляет собой тирозинкиназу.
Посредством аутофосфорилирования активируются различные пути, в частности, путь PI-3-K (фосфоинозитол-3-кеназа), за счет которого и происходит транспорт глюкозы внутрь клетки, так как приходит в свое активное рабочее состояние транспортер глюкозы GLUT4.
За счет активного липолиза свободных жирных кислот (СЖК) и провоспалительных цитокинов, они влияют на субстраты инсулинового рецептора и тем самым блокируется путь PI-3-K, в результате чего блокируются эффекты, которые оказывает этот путь на обмен глюкозы, и глюкоза не может войти в клетку. Таким способом развивается инсулинорезистентность, т.е. чрезмерное количество висцеральной жировой ткани блокирует инсулиновый сигнал и приводит к тому, что инсулиновые рецепторы становятся нечувствительны к инсулину, и его биологическая роль извращается.
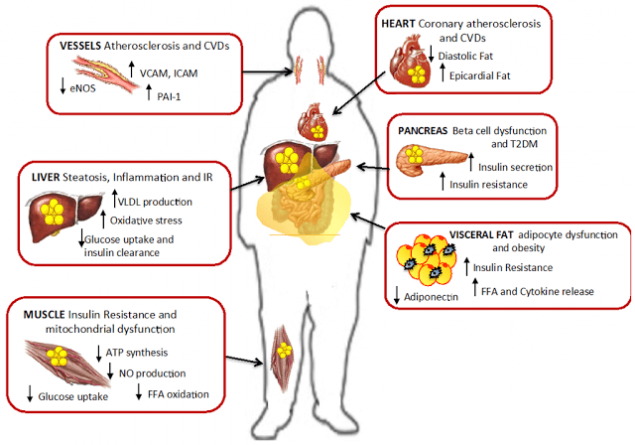
В зависимости от индивидульной чувствительности и генетики, инсулинорезистентность может развиваться в разных тканях. Избыток СЖК опосредует прогрессирование инсулинорезистентности многих тканей — мышечной, в том числе миокардиальной, печеночной, адипозной, а также эндотелиальных клеток, способствует прогрессированию ишемических изменений в миокарде, в том числе изменений, связанных с нарушением бета-окисления СЖК в миокарде.
Шаг пятый: печеночная и мышечная инсулинорезистентность.
В условиях повышенного поступления в организм пищи, богатой жирами и углеводами, стимулируется секреция инсулина, который, в свою очередь, активирует липогенез и отложение СЖК в жировой ткани. Однако имеется генетически-детерминированный предел способности накапливать липиды, поэтому когда объем жировой ткани достигает максимума, избыток СЖК начинает поступать в печень и мышцы.
Избыток СЖК сопровождается накоплением триглицеридов в паренхимальных клетках многих тканей, а именно в скелетных и кардиальных миоцитах и в гепатоцитах, что ведет к их повреждению и хронической дисфункции.
В результате, печень в условиях инсулиновой резистентности начинает активно синтезировать жирные кислоты, триглицериды, ускоряется липолиз, но уже в жировой ткани. Кроме того, в печени происходят все те процессы, которые приводят пациента с висцеральным ожирением к сахарному диабету: стимулируется глюконеогенез и подавляется гликолиз и синтез гликогена.
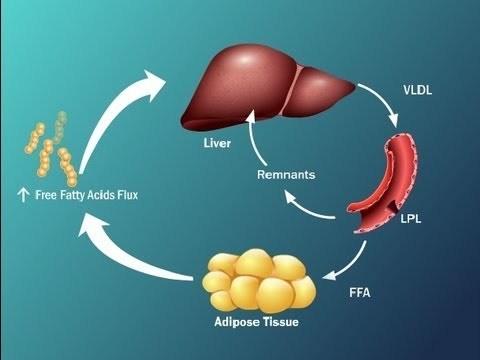
Выяснена достаточно сложная схема, которая отражает, что инсулиновая резистентность, или резистентность к инсулину, приводит к тому, что печень у нас становится перегруженной жирными кислотами.
Это за счет того, что синтезируются активные жирные кислоты в печени, снижается окисление жирных кислот, активно идут жирные кислоты в печень из висцеральной жировой ткани и, кроме того, жир, который в составе хиломикронов попадает к нам в печень, также перегружает печень свободными жирными кислотами.
Данные процессы приводят к тому, что печень не в состоянии метаболизировать путем β-окисления СЖК, включается перекисное окисление липидов, в результате чего в большом количестве продуцируются активные формы кислорода, возникает оксидативный стресс, и именно эти факторы приводят к фосфорилированию субстрата инсулинового рецептора, о чем мы говорили на предыдущем слайде, тем самым, опять запускается резистентность к инсулину, т.е. возникает своеобразный порочный круг, и уже определить у пациента, что первично, достаточно сложно.
Кроме того, доказано, что макрофаги висцеральной жировой ткани обладают провоспалительной активностью. Также в жировой ткани найдены и CD-8 + Т-лимфоциты, которые активно выделяют провоспалитеные цитокины и, тем самым, в печень в состоянии жировой дистрофии уже может переходить и в следующую стадию с развитием у пациентов НАСГ и других последствий, к которым ведет НАЖБП.
Мышечная инсулинорезистентность.
Вскоре после печени, жир начинает накапливаться в мышцах. Характерная для ИР метаболическая патология – накопление вокруг мышечных фибрилл триглицеридов. Однако накопление триглицеридов внутри скелетных мышц, как полагается, не является непосредственной причиной развития СД 2, но, похоже. может быть маркером интермедиатов липидов. таких, как ацетил КоА, церамиды и диацилглицерин
Согласно недавним исследованиям, нарушение пути передачи инсулинового сигнала связано, в основном, с патологическим метаболизмом СЖК в клетках скелетных мышц, «не справляющихся» с их утилизацией, когда СЖК в избытке. Действительно, локальное накопление внутри скелетных мышц таких метаболитов СЖК, как церамиды, диаглицерол или ацил-КоА ведет к нарушению передачи инсулинового сигнала и, тем самым, к нарушению транспорта глюкозы.
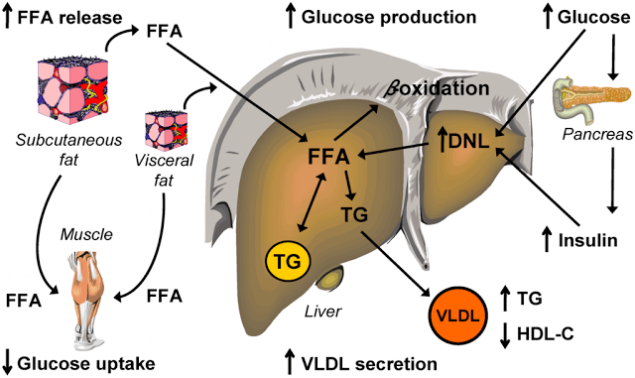
Шаг шестой. Порочный круг инсулинорезистентности.
Инсулинорезистентность, вызванная высоким уровнем СЖК, еще больше повышает концентрацию СЖК в плазме. Как обнаружилось, инсулинорезистентные жировые клетки секретируют повышенные уровни СЖК. Это, собственно, и позволяет считать повышенные уровни СЖК маркером ИР.
Действительно, при ИР уровень СЖК в гепатоцитах повышается, т.к., в них:
1) повышается липогенез de novo,
2) этерификиця СЖК превышает их окисление,
3) этерифицированные ЖК запасаются в виде триглицеридов или направляются на синтез Х-ЛПОНП (богатых триглицеридами),
4) понижается регулируемая инсулином мобилизация триглицеридов.
Инсулинорезистентные адипоциты интенсивно расщепляют содержащиеся в них триглицериды и высвобождают образовавшиеся из них СЖК в кровоток (как при ожирении, так и без него). Поток СЖК из жировых клеток повышается и, более того, СЖК также выходят из Х-ЛПОНП и из хиломикронов плазмы и по кровотоку частично направляются в другие органы, а частично – обратно в печень, где снова превращаются в триглицериды. Происходит «накачка» печени СЖК и триглицеридами. Это имеет самые тяжкие последствия.
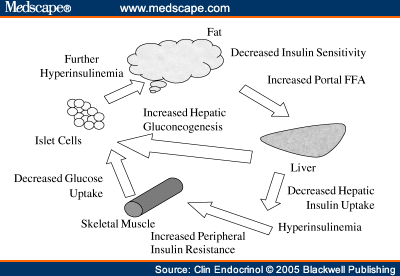
Шаг седьмой. Ускорение атеросклероза.
Повышенные уровни СЖК приводят к дислипидемии и атерогенезу
Как инсулинорезистентность ведет к дислипидемии Повышение в печени триглицеридов стимулирует образование Апо В и Х-ЛПОНП,
Вот как это происходит.
1) Из печени высокие уровни Х-ЛПОНП секретируются в плазму, где из-за липолиза из Х-ЛПОНП образуются СЖК и высокоатерогенные ремнантные (остаточные) частицы липопротеинов, богатых триглицеридами.
2) Из плазмы СЖК и ремнантные частицы снова поглощаются печенью, что еще больше повышает уровень СЖК в гепатоцитах и еще больше стимулирует синтез Х-ЛПОНП.
3) В печени, при высоком уровне Х-ЛПОНП и нормальном уровне белка CETP (cholesteryl ester transfer protein) – переносчика эфира холестерина, триглицериды из Х-ЛПОНП переходят в Х-ЛПВП, а холестерин из Х-ЛПВП переходит в Х-ЛПОНП. В итоге образуются: а) богатые холестерином очень атерогенные ремнантные частицы Х-ЛПОНП и б) Х-ЛПВП, содержащий много триглицеридов и мало холестерина.
4) Такие частицы Х-ЛПВП теряют триглицериды (под действием печеночной липазы) и свой основной аполипопротеин Апо А1. В итоге уровень антитерогенного Х-ЛПВП понижается.
5) При высоком уровне Х-ЛПОНП (богатых триглицеридами), CETP переносит триглицериды из Х-ЛПОНП в Х-ЛПНП, а холестерин – из Х-ЛПНП в Х-ЛПОНП.
6) Богатые триглицеридами Х-ЛПНП из-за активности печеночной или липопротеиновой липазы теряют триглицериды, уменьшаются в размерах и становятся очень атерогенными мелкими плотными частицами Х-ЛПНП.
Таким образом, повышенные уровни СЖК приводят к снижению уровня «антиатерогенного» Х-ЛПВП, образованию крайне атерогенных мелких плотных частиц Х-ЛПНП и повышению плазменных уровней триглицеридов.
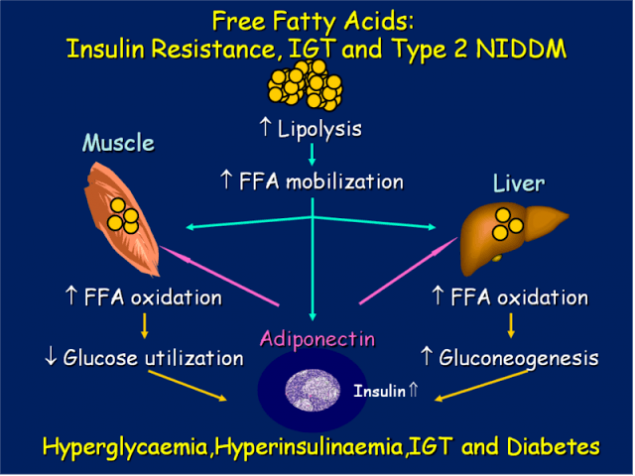
Но есть еще один путь, которым высокие уровни СЖК вызывают атерогенез. Этот путь более прямой и короткий. Повышенный при ИР уровень СЖК вызывает в митохондриях макрососудистых эндотелиальных клеток сверхсинтез активных форм кислорода, что ведет к окислению Х-ЛПНП и модификации Х-ЛПВП. Это индуцирует воспалительный процесс в стенках сосудов, образование и накопление холестериновых бляшек и, в результате – ишемию.опубликовано
Источники.
1. Публикации В.В. Велькова
2. В.В. Вельков. Лабораторная диагностика. – 2009. – Т. 3, № 49. – С. 55–71.
3. Вельков В.В. Свободные жирные кислоты – фактор риска инсулинорезистентности и ишемии: перспективы для оценки рисков и диагностики
4. Л.И.Данилова Феномен инсулинорезистентности в клинической практике: механизмы формирования и возможности коррекции
5. Е.В. Терешина Роль жирных кислот в развитии возрастного окислительного стресса. Успехи геронтологии, 2007. Т. 20, № 1
6. «Эндокринология и метаболизм», Ф.Фелиг, Д.Бакстер
Автор: Андрей Беловешкин
Психосоматика заболеваний шеи: Через горло мы «проглатываем» действительность
Источник: www.beloveshkin.com/2016/01/svobodnye-zhirnye-kisloty-klyuch-k-ponimaniyu-insulinorezistentnosti.html
Поэтому сегодня я расскажу про СЖК – свободные жирные кислоты (на иллюстрациях обозначены как FFA – free fatty acids). С одной стороны СЖК – это главный источник энергии, но с другой стороны – это и важная сигнальная молекула.
Особо хочу отметить, что когда речь идет о хроническом повышении СЖК как причине инсулинорезистентности (ИР), то помните, что проблема не в СЖК, а в том, что им некуда использоваться, поэтому в крови появляется их избыток. Статья получилась большой, но кому интересно понять логику здоровья и болезни – то добро пожаловать.

Свободные жирные кислоты: ключ к пониманию инсулинорезистентности
Свободные жирные кислоты.
Свободные (или не этерифицированные) жирные кислоты (СЖК) образуются в результате гидролиза триглицеридов, содержащихся в жировых тканях. Плазменные жирные кислоты или этерифицированы и в этом случае большей частью связаны с альбумином или не этерифицированы и находятся в свободном состоянии. Свободные жирные кислоты (СЖК) входят в состав липопротеинов 5-го класса.
Последние состоят из длинноцепочечных жирных кислот, прочно связанных с двумя специфическими участками молекулы альбумина; при повышении уровня СЖК в плазме они занимают дополнительные участки этой молекулы, но связь в данном случае оказывается менее прочной.
СЖК представляют собой, главный энергетический субстрат организма. Они образуются в процессе липолиза триглицеридов, накопленных в клетках жировой ткани. Тканевая липаза в этих клетках находится под нейроэндокринным контролем, и ее активация осуществляется через аденилатциклазную систему.
Вторым источником СЖК плазмы служит гидролиз триглицеридов, содержащихся в липопротеинах, под влиянием липопротеиновой липазы. Способность скелетных мышц (и других тканей) подстраивать свой метаболизм к доминирующему в данный момент субстрату принято называть «хорошим метаболическим здоровьем» или «метаболической гибкостью». Понятно, что хорошее «метаболическое здоровье» связано с нормальной чувствительностью к инсулину.
Обмен свободных жирных кислот.
Период полужизни СЖК весьма непродолжителен — 4 — 8 мин, и они легко поглощаются из плазмы мышечными клетками организма. Второй путь их обмена заключается в поглощении печенью и ресинтезе в триглицериды, которые затем могут транспортироваться из печени в составе ЛПОНП или окисляться до ацетил-СоА. В физиологических условиях уровень СЖК в крови может повышаться и снижаться очень быстро, удовлетворяя потребность организма в этой форме энергии.
Их содержание обычно ниже после всасывания углеводов и возникающего вследствие этого выброса инсулина, но по мере снижения уровня глюкозы в крови после еды их уровень повышается. Натощак в крови содержится, как правило, 400 — 600 мкэкв/л СЖК; при более длительном голодании (до 24 — 72 ч) уровень СЖК может достигать 1000 — 1500 мкэкв/л. Глюкагон, адреналин, гормон роста и АКТГ также повышают уровень СЖК. Главными физиологическими регуляторами содержания СЖК в плазме служат инсулин и адреналин.
Каждую минуту утилизируется 20-40% СЖК, попадающих в плазму, — они окисляются, реэтерифицируются или превращаются в другие жирные кислоты. Во время покоя окисление происходит, в основном, в печени и в сердце, а при нагрузках — в скелетных мышцах, причем в последнем случае доля окисляющихся СЖК, возрастает приблизительно от 20 до 60%.
Большинство СЖК, захваченных клетками печени, реэтерифицируется с образованием главным образом триглицеридов, а также фосфолипидов, для синтеза которых используется, как правило, линолевая кислота. В плазме СЖК обнаруживаются в диапазоне концентраций от 100 мкмоль/л до 1 ммоль/л и их уровень сильно зависит от времени суток.
После каждого приема пищи уровень СЖК в плазме падает, так как инсулин подавляет в жировых клетках липолиз, в результате которого и образуются СЖК. В ночное время концентрация СЖК в плазме возрастает. К этим нормальным суточным колебаниям уровней СЖК «подстраиваются» почти все другие ткани, в частности, скелетные мышцы, которые «переключаются» с утилизации глюкозы (днем) на потребление СЖК (ночью).
Некоторые причины нарушения обмена СЖК.
Ключевое нарушение обмена свободных жирных кислот – это их хроническое повышение. Хроническое повешение уровня СЖК может быть вызвано множеством причин пищевого и стрессового типа. Например, избыток углеводов, при котором начинается синтез новых жирных кислоты из избытка углеводов.
Поскольку у здорового человека 75-80% глюкозы утилизируется скелетной мускулатурой, то физическая активность рабочих тяжелого труда может предотвратить развитие «функциональной» резистентности к инсулину. Недостаток физической активности также вызывает повышение СЖК.
Хронический стресс любого типа – это еще одна причина хронического повышения СЖК. Во время стресса в крови повышается уровень СЖК для обеспечения работы сердца и мышц. Но человек обычно не двигается и все эти жирные кислоты циркулируют в крови длительное время.
В широкомасштабных исследованиях обнаружена обратная зависимость между положением человека на социально-экономической лестнице и вероятностью развития метаболического синдрома. Делается вывод, что развитие метаболического синдрома – биологический механизм, приводящий к «социальному неравенству в распределении коронарного риска среди людей».
Высокие коронарные риски (повышенный уровень триглицеридов и низкий уровень холестерина-липопротеидов высокой плотности) связаны с низким социально-экономическим статусом («бедным детством»), что в зрелые годы приводит к избыточному весу и ожирению.
Кроме того, психологические стрессы также способствуют развитию СД1 и СД2, так как высокий уровень СЖК связан с повышенным образованием в митохондриях активных форм кислорода (оксидативный стресс), что в конечном итоге ведет к снижению способности клеток адекватно реагировать на действие инсулина.
СЖК – и метаболит, и сигнальная молекула.
Многочисленные исследования последних лет показали, что, во-первых, СЖК – это не только высокоэнергетическое топливо, но и важные сигнальные молекулы. Их концентрация – важный регуляторный фактор, влияющий на интенсивность утилизации глюкозы в мышцах.
И, второе, адипозные ткани – это еще и важнейший эндокринный орган, который секретирует большое количество факторов, названных адипоцитокинами, которые имеют или сенсибилизирующее влияние на инсулин (это адипонектин и лептин), в частности, фактора некроза опухолей – альфа (ФНО- альфа), резистин и др.
При избыточном количестве адипозных тканей происходит их избыточный липолиз. В норме высвобождение СЖК из адипозных тканей строго регулируется, что обеспечивает другие ткани четко сбалансированным количеством СЖК, необходимым для адекватного удовлетворения их энергетических нужд.
Но при ожирении в кровоток поступают, таким образом, патологически повышенные количества сигнальных молекул (в особенности, ФНО-альфа), что ведет к нарушению метаболического гомеостаза. Таким образом, самые ранние события, приводящие к нарушению механизма действия инсулина и возникновение ИР, происходят именно в адипозных клетках и задолго до возникновения нарушенной толерантности к глюкозе.

Профиль свободных жирных кислот в сыворотке меняется в зависимости от пола и возраста, режима питания, изменения гормонального статуса; например, адреналэктомия или кастрация приводят к изменению профиля ЖК.
Изменение концентрации свободных ЖК в свою очередь приводит к значительным изменениям на двух стадиях переноса гормональной информации: связывания глюкокортикоидов с их специфическими белками-носителями в плазме и с тканевыми рецепторами.
С современных позиций свободные жирные кислоты более не рассматриваются как пассивные субстраты, вовлеченные в метаболические процессы. Свободные жирные кислоты – это важные метаболические сигналы и участники липидных нарушений. В ряде ситуаций они ведут себя как гормоноподобные молекулы, влияя на транскрипцию генов, связываясь с рядом рецепторов.
Среди рецепторов, которые связываются со СЖК/FFA или их дериватами, особое место занимают пероксисом пролифератор-активированные рецепторы – PPARs. Также сопряжённый с G-белком рецептор GPR120, который в большом количестве экспрессируется в кишечнике, функционирует как рецептор для ненасыщенных длинноцепочечных свободных жирных кислот FFA. Стимуляция GPR120 свободными жирными кислотами способствует секреции GLP-1 и повышает количество циркулирующего инсулина.
Свободные жирные кислоты и здоровье.
В зарубежной медицинской литературе свободные жирные кислоты (СЖК) или неэстерифицированные жирные кислоты, которые образуются в результате гидролиза три-глицеридов, содержащихся в адипозных тканях, называют «красной лампочкой на приборной доске миокарда».
Повышение их плазменных уровней сигнализирует о возрастающей опасности: вначале о метаболическом синдроме, потом об инсулинорезистентности, диабетической кардиомиопатии, а далее – ишемической болезни сердца. Далее эта лампочка может перегореть, и вспыхнут «лампочки» маркеров некроза миокарда, свидетельствующие, что «точка невозврата» пройдена.
Таким образом, повышенные уровни СЖК прямым образом связаны с ожирением, т.е. «эти лампочки начинают светиться задолго до развития конечной точки», что делает возможным эффективное проведение корригирующих мероприятий.
Многочисленные результаты недавних исследований четко указывают: повышенные уровни СЖК, вызванные избыточным количеством жировой ткани – если не первая, то, по крайней мере, одна из главных причин возникновения ИР. Многократно и достоверно показано, что большинство пациентов, страдающих ожирением, метаболическим синдромом и сахарным диабетом второго типа (СД 2), имеют повышенные уровни СЖК, что приводит к ИР многих тканей – жировой, мышечных, печени, а также эндотелиальных клеток.
СЖК – независимый предиктор нарушения толерантности к глюкозе и СД 2. Итак, повышенный поток СЖК из большой массы адипозных клеток, а также нарушения в механизмах, хранения триглицеридов и в механизмах липолиза в тканях, исходно нормально чувствительных к инсулину – это, похоже, самые ранние проявления аномалий, приводящих к ИР.
Принципиально, что эти нарушения обнаруживаются еще до развития постпрандиальной гипергликемии или до развития гипергликемии натощак. Действительно, повышение натощак плазменных уровней СЖК, пожалуй, самое ранее указание на будущее нарушение толерантности к глюкозе.

Лестница исулинорезистентности.
Шаг первый: нарушение лептиновой регуляции (лептинорезистентность).
В распределении жирных кислот в организме человека участвуют преимущественно два гормона: гормон роста, который контролирует мобилизацию жирных кислот из жировой ткани, и лептин, который контролирует β-окисление жирных кислот в митохондриях.

Одна из важных функций лептина – это удержание триглицеридов в адипоцитах. Нормальный уровень лептина защищает прочие органы от накопления жира (сосуды, печень, мышцы и др.). Лептин активирует карнитин-пальмитоил-трансфера зу-1, которая связывает жирную кислоту с карнитином, а последний переносит ее через мембрану митохондрий, и этот процесс строго регулируется. Лептин также стимулирует окисление жирных кислот и уменьшает количество триацилглицеровлов в мышечной ткани. Также установлено, что лептин подавляет активность ацетил-КоА-карбоксилазы!
Хронические стрессы, переедание, недоедание, избыток сахара, гиподинамия приводят к нарушению работы лептиновой системы. Если возникает резистентность к лептину, то это приводит к увеличению количества свободных жирных кислот. Наступает второй шаг – хроническое повышение СЖК.
Шаг второй: увеличение висцеральной жировой ткани.
Именно висцеральная жировая ткань будет мощнейшим источником СЖК. Висцеральный жир увеличивается пропорционально индексу массы тела и является независимым предиктором развития сахарного диабета 2 типа. Висцеральная жировая ткань – это основной источник свободных жирных кислот (СЖК).
При висцеральном ожирении в печень через систему воротной вены поступает чрезмерное (в 20-30 раз превышающее норму) количество свободных жирных кислот, что подвергает печень серьёзным перегрузкам и, в итоге, приводит к развитию указанных выше метаболических нарушений.
Висцеральный жир, присутствующий вокруг внутренних органов, брыжейке и сальнике, отличается от подкожного по типу адипоцитов, их эндокринной функции, липолитической активности, чувствительности к инсулину и другим гормонам.
В отличие от подкожной жировой ткани, венозная кровь, оттекающая от висцерального жира, через портальную систему напрямую поступает в печень. Это обусловливает непосредственное поступление в печень большого количества свободных жирных кислот (СЖК) и адипокинов, синтезирую- щихся в висцеральной жировой ткани.
Адипокины, в свою очередь, активируют печеночные иммунные механизмы, ведущие к образованию провоспалительных медиаторов, таких как С-реактивный белок (СРБ) и другие. Свободные жирные кислоты, в большом количестве поступающие в печень из висцеральной жировой ткани, обусловливают развитие печеночной инсулинорезистентности.
Секретируя моноцитарный хемоаттрактантный протеин-1 (MCP-1), способствующий макрофагальной инфильтрации жировой ткани, адипоциты обусловливают провоспалительное состояние.
Макрофаги, в свою очередь, представляют собой важный источник провоспалительных цитокинов, таких как фактор некроза опухолей-α (ФНО-α) и интерлейкин-6 (ИЛ-6). Висцеральная жировая ткань отличается большей инфильтрацией воспали- тельными клетками, и поэтому секретирует большие количества провоспалительных цитокинов по сравнению с подкожным жиром
Эктопический жир - т.е. жир, которые находится не в подкожно-жировой клетчатке. Этот жир чаще всего висцеральный, или печеночный, или межмышечный. Но его объединяет то, что это не подкожный жир, а находящийся с «неправильном» месте. Дальнейшее развитие болезни будет зависеть от того, в каких именно тканях, не предназначенных для их хранения, будут накапливаться СЖК. Если они накапливаются в скелетных мышцах – это приведет к ИР, если в печени – к дислипидемии. Сначала, как правило, развивается ИР, потом, с ее утяжелением – ишемическая болезнь сердца – ИБС.
Шаг третий: хроническое повышение СЖК.
Как было показано выше, при висцеральном ожирении в печень через систему воротной вены поступает чрезмерное (в 20-30 раз превышающее норму) количество свободных жирных кислот, что подвергает печень серьёзным перегрузкам и, в итоге, приводит к развитию указанных выше метаболических нарушений. В крови появляется хронический повышенный уровень СЖК. Вместе с лептинорезистентностью это постепенно приводит к увеличению количества жира в нежировых органах.
Под действием СЖК в жировой ткани образуются более крупные адипоциты, резистентные к действию инсулина, инициируется процесс местного воспаления, увеличивается секреция провоспалительных цитокинов.
Хроническое повышение уровня жирных кислот в крови является следствием нарушения в организме системы регулирования их гомеостаза. Резистентность к лептину, по-видимому, не допускает превышения некого его стационарного предела окисления и, следовательно, утилизации избыточного количества жирных кислот в митохондриях.
Поэтому, как можно предположить, возникает ситуация, когда, вследствие повышенного содержания жирных кислот в околоклеточном пространстве, их поток в клетку усиливается (из-за повышения содержания жирных кислот в организме ввиду их недорасходования), а при одновременной резистентности к лептину окисление жирных кислот остается на прежнем уровне.
Возможно, обратная связь между поступлением жирных кислот в клетку нежировой ткани и их секрецией в кровь либо нарушается, либо она вообще не существует, т.е. отсутствует механизм поддержания стационарного уровня жирных кислот в крови. Если такое предположение верно, то в этом отношении регуляция метаболизма жирных кислот принципиально отличается от регуляции обмена глюкозы, стационарный уровень которой поддерживается системой гормонов.
Под контролем находится, вероятно, только окисление жирных кислот в митохондриях, т.е. внутриклеточная утилизация этого энергетического субстрата. В последние годы исследуются механизмы регуляции потока жирных кислот в организме.
Было открыто семейство ядерных рецепторов PPAR, они стали известны в связи со способностью индуцировать пролиферацию пероксисом и канцерогенез в печени в ответ на воздействие ксенобиотиков. Открыты три изоформы PPAR— α, γ и δ, и наиболее изучены свойства рецеп торов PPARα и PPARγ. Лигандами для рецепторов служат насыщенные, ненасыщенные и мононенасыщенные жирные кислоты.
PPARγ экспрессируется в адипоцитах и снижает секрецию жирных кислот в кровь из жировой ткани. PPARα экспрессируется в клетках печени, скелетной и сердечной мышц и действует как «липостат», регулируя процессы внутриклеточного синтеза и β-окисления жирных кислот в митохондриях и пероксисомах.
PPAR стимулируются лептином, гормоном роста и инсулином, их экспрессия подчиняется циркадному ритму, они экспрессируются в ответ на прием пищи. Эти рецепторы осуществляют внутриклеточную регуляцию жирных кислот, поддерживая стационарный уровень потребления энергии клеткой, но они, по-видимому, все-таки не участвуют в поддержании гомеостаза жирных кислот на уровне организма.

Шаг четвертый: возникновение инсулирезистентности.
Повышенный уровень СЖК приводит к накоплению их в клетках, перестройке клеточных мембран и снижению инсулинорезистентности. Избыток триглицеридов в клетках вызывает увеличение синтеза воспалительных цитокинов. Именно жировые ткани в данный момент рассматриваются как место первоначального возникновения и развития ИР. Это происходит из-за: а) поступления в кровоток повышенных уровней СЖК и, 2) повышенной секреции адипоцитокинов.
Большая масса адипоцитов синтезирует повышенные количества провоспалительных цитокинов, что приводит к хроническому воспалительному процессу, который: а) нарушает путь передачи инсулинового сигнала и, б) повреждает функции митохондрий, что нарушает гомеостаз глюкозы. В частности, секретируемые жировыми клетками ИЛ-6 и ФНО-альфа утяжеляют ИР, а секретируемый ангиотензин II, повышает артериальное давление и способствует развитию атеросклероза.
Нарушение приспособительного механизма.
В клетке из жирных кислот, не израсходованных на β-окисление, сначала синтезируются фосфолипиды, а затем триглицериды, которые аккумулируются в цитоплазме. Внутриклеточные триглицериды в нежировых тканях содержат преимущественно пальмитиновую кислоту. Из пальмитиновой кислоты синтезируется сфингомиелин, который является основным компонентом мембранных рафтов, участвующих в регуляции активности мембранных рецепторов.
Синтез сфингомиелина, зависящий от содержания в клетке пальмитино вой кислоты, осуществляется по пути «пальмитиновая кислота → церамид → сфингомиелин». Именно путь синтеза церамида из пальмитиновой кислоты приводит к оксидативному апоптозу. Церамид является индуктором апоптоза как по окислительному пути (церамид блокирует комплекс III ЭТЦ, вызывая усиленную генерацию оксидантов), так и без вовлечения митохондрий.
Накопление триглицеридов в кардиомиоцитах ассоциировано со снижением синтеза кардиолипина и изменением дыхательной функции митохондрий, так как цитохром с оксидаза комплекса IV ЭТС связана с кардиолипином. Изменение структуры мембраны митохондрий приводит к высвобождению цитохрома с и к апоптозу без участия оксидантов. Таким образом, аккумуляция пальмитиновой кислоты в клетках нежировых тканей ведет к повышению синтеза церамида и снижению синтеза кардиолипина, что индуцирует апоптоз, и к изменению активности рецепторов.
В связи с этим аккумуляцию в клетках триглицеридов (сами триглицериды не индуцируют апоптоз) рассматривают как попытку организма избежать эффекта липотоксичности.
Сфингомиелин и пальмитиновая кислота проявляют высокую аффинность к холестерину. Увеличением содержания сфингомиелина и пальмитиновой кислоты в мембране можно объяснить ассоциированное с возрастом накопление в мембранах холестерина, а также изменение чувствительности инсулинового рецептора.

Инсулиновый рецептор связан с мембранными рафтами, и изменение состава рафтов влияет на его чувствительность. Аккумуляция триглицеридов в нежировых тканях и сопряженное с этим снижение чувствительности инсулинового рецептора ведет к возникновению резистентности к инсулину и гипергликимии, т.е. к повышенному содержанию глюкозы в крови. Рецептор к инсулину представляет собой тирозинкиназу.
Посредством аутофосфорилирования активируются различные пути, в частности, путь PI-3-K (фосфоинозитол-3-кеназа), за счет которого и происходит транспорт глюкозы внутрь клетки, так как приходит в свое активное рабочее состояние транспортер глюкозы GLUT4.
За счет активного липолиза свободных жирных кислот (СЖК) и провоспалительных цитокинов, они влияют на субстраты инсулинового рецептора и тем самым блокируется путь PI-3-K, в результате чего блокируются эффекты, которые оказывает этот путь на обмен глюкозы, и глюкоза не может войти в клетку. Таким способом развивается инсулинорезистентность, т.е. чрезмерное количество висцеральной жировой ткани блокирует инсулиновый сигнал и приводит к тому, что инсулиновые рецепторы становятся нечувствительны к инсулину, и его биологическая роль извращается.
В зависимости от индивидульной чувствительности и генетики, инсулинорезистентность может развиваться в разных тканях. Избыток СЖК опосредует прогрессирование инсулинорезистентности многих тканей — мышечной, в том числе миокардиальной, печеночной, адипозной, а также эндотелиальных клеток, способствует прогрессированию ишемических изменений в миокарде, в том числе изменений, связанных с нарушением бета-окисления СЖК в миокарде.
Шаг пятый: печеночная и мышечная инсулинорезистентность.
В условиях повышенного поступления в организм пищи, богатой жирами и углеводами, стимулируется секреция инсулина, который, в свою очередь, активирует липогенез и отложение СЖК в жировой ткани. Однако имеется генетически-детерминированный предел способности накапливать липиды, поэтому когда объем жировой ткани достигает максимума, избыток СЖК начинает поступать в печень и мышцы.
Избыток СЖК сопровождается накоплением триглицеридов в паренхимальных клетках многих тканей, а именно в скелетных и кардиальных миоцитах и в гепатоцитах, что ведет к их повреждению и хронической дисфункции.
В результате, печень в условиях инсулиновой резистентности начинает активно синтезировать жирные кислоты, триглицериды, ускоряется липолиз, но уже в жировой ткани. Кроме того, в печени происходят все те процессы, которые приводят пациента с висцеральным ожирением к сахарному диабету: стимулируется глюконеогенез и подавляется гликолиз и синтез гликогена.

Выяснена достаточно сложная схема, которая отражает, что инсулиновая резистентность, или резистентность к инсулину, приводит к тому, что печень у нас становится перегруженной жирными кислотами.
Это за счет того, что синтезируются активные жирные кислоты в печени, снижается окисление жирных кислот, активно идут жирные кислоты в печень из висцеральной жировой ткани и, кроме того, жир, который в составе хиломикронов попадает к нам в печень, также перегружает печень свободными жирными кислотами.
Данные процессы приводят к тому, что печень не в состоянии метаболизировать путем β-окисления СЖК, включается перекисное окисление липидов, в результате чего в большом количестве продуцируются активные формы кислорода, возникает оксидативный стресс, и именно эти факторы приводят к фосфорилированию субстрата инсулинового рецептора, о чем мы говорили на предыдущем слайде, тем самым, опять запускается резистентность к инсулину, т.е. возникает своеобразный порочный круг, и уже определить у пациента, что первично, достаточно сложно.
Кроме того, доказано, что макрофаги висцеральной жировой ткани обладают провоспалительной активностью. Также в жировой ткани найдены и CD-8 + Т-лимфоциты, которые активно выделяют провоспалитеные цитокины и, тем самым, в печень в состоянии жировой дистрофии уже может переходить и в следующую стадию с развитием у пациентов НАСГ и других последствий, к которым ведет НАЖБП.

Мышечная инсулинорезистентность.
Вскоре после печени, жир начинает накапливаться в мышцах. Характерная для ИР метаболическая патология – накопление вокруг мышечных фибрилл триглицеридов. Однако накопление триглицеридов внутри скелетных мышц, как полагается, не является непосредственной причиной развития СД 2, но, похоже. может быть маркером интермедиатов липидов. таких, как ацетил КоА, церамиды и диацилглицерин
Согласно недавним исследованиям, нарушение пути передачи инсулинового сигнала связано, в основном, с патологическим метаболизмом СЖК в клетках скелетных мышц, «не справляющихся» с их утилизацией, когда СЖК в избытке. Действительно, локальное накопление внутри скелетных мышц таких метаболитов СЖК, как церамиды, диаглицерол или ацил-КоА ведет к нарушению передачи инсулинового сигнала и, тем самым, к нарушению транспорта глюкозы.

Шаг шестой. Порочный круг инсулинорезистентности.
Инсулинорезистентность, вызванная высоким уровнем СЖК, еще больше повышает концентрацию СЖК в плазме. Как обнаружилось, инсулинорезистентные жировые клетки секретируют повышенные уровни СЖК. Это, собственно, и позволяет считать повышенные уровни СЖК маркером ИР.
Действительно, при ИР уровень СЖК в гепатоцитах повышается, т.к., в них:
1) повышается липогенез de novo,
2) этерификиця СЖК превышает их окисление,
3) этерифицированные ЖК запасаются в виде триглицеридов или направляются на синтез Х-ЛПОНП (богатых триглицеридами),
4) понижается регулируемая инсулином мобилизация триглицеридов.
Инсулинорезистентные адипоциты интенсивно расщепляют содержащиеся в них триглицериды и высвобождают образовавшиеся из них СЖК в кровоток (как при ожирении, так и без него). Поток СЖК из жировых клеток повышается и, более того, СЖК также выходят из Х-ЛПОНП и из хиломикронов плазмы и по кровотоку частично направляются в другие органы, а частично – обратно в печень, где снова превращаются в триглицериды. Происходит «накачка» печени СЖК и триглицеридами. Это имеет самые тяжкие последствия.

Шаг седьмой. Ускорение атеросклероза.
Повышенные уровни СЖК приводят к дислипидемии и атерогенезу
Как инсулинорезистентность ведет к дислипидемии Повышение в печени триглицеридов стимулирует образование Апо В и Х-ЛПОНП,
Вот как это происходит.
1) Из печени высокие уровни Х-ЛПОНП секретируются в плазму, где из-за липолиза из Х-ЛПОНП образуются СЖК и высокоатерогенные ремнантные (остаточные) частицы липопротеинов, богатых триглицеридами.
2) Из плазмы СЖК и ремнантные частицы снова поглощаются печенью, что еще больше повышает уровень СЖК в гепатоцитах и еще больше стимулирует синтез Х-ЛПОНП.
3) В печени, при высоком уровне Х-ЛПОНП и нормальном уровне белка CETP (cholesteryl ester transfer protein) – переносчика эфира холестерина, триглицериды из Х-ЛПОНП переходят в Х-ЛПВП, а холестерин из Х-ЛПВП переходит в Х-ЛПОНП. В итоге образуются: а) богатые холестерином очень атерогенные ремнантные частицы Х-ЛПОНП и б) Х-ЛПВП, содержащий много триглицеридов и мало холестерина.
4) Такие частицы Х-ЛПВП теряют триглицериды (под действием печеночной липазы) и свой основной аполипопротеин Апо А1. В итоге уровень антитерогенного Х-ЛПВП понижается.
5) При высоком уровне Х-ЛПОНП (богатых триглицеридами), CETP переносит триглицериды из Х-ЛПОНП в Х-ЛПНП, а холестерин – из Х-ЛПНП в Х-ЛПОНП.
6) Богатые триглицеридами Х-ЛПНП из-за активности печеночной или липопротеиновой липазы теряют триглицериды, уменьшаются в размерах и становятся очень атерогенными мелкими плотными частицами Х-ЛПНП.
Таким образом, повышенные уровни СЖК приводят к снижению уровня «антиатерогенного» Х-ЛПВП, образованию крайне атерогенных мелких плотных частиц Х-ЛПНП и повышению плазменных уровней триглицеридов.

Но есть еще один путь, которым высокие уровни СЖК вызывают атерогенез. Этот путь более прямой и короткий. Повышенный при ИР уровень СЖК вызывает в митохондриях макрососудистых эндотелиальных клеток сверхсинтез активных форм кислорода, что ведет к окислению Х-ЛПНП и модификации Х-ЛПВП. Это индуцирует воспалительный процесс в стенках сосудов, образование и накопление холестериновых бляшек и, в результате – ишемию.опубликовано
Источники.
1. Публикации В.В. Велькова
2. В.В. Вельков. Лабораторная диагностика. – 2009. – Т. 3, № 49. – С. 55–71.
3. Вельков В.В. Свободные жирные кислоты – фактор риска инсулинорезистентности и ишемии: перспективы для оценки рисков и диагностики
4. Л.И.Данилова Феномен инсулинорезистентности в клинической практике: механизмы формирования и возможности коррекции
5. Е.В. Терешина Роль жирных кислот в развитии возрастного окислительного стресса. Успехи геронтологии, 2007. Т. 20, № 1
6. «Эндокринология и метаболизм», Ф.Фелиг, Д.Бакстер
Автор: Андрей Беловешкин
Психосоматика заболеваний шеи: Через горло мы «проглатываем» действительность
Что мы НЕ ДОЛЖНЫ лечить
Источник: www.beloveshkin.com/2016/01/svobodnye-zhirnye-kisloty-klyuch-k-ponimaniyu-insulinorezistentnosti.html